1.2.1. Les transporteurs d'oxygène
1.2.2. Propriétés des transporteurs
a. pouvoir oxyphorique - affinité
1. Affinité - adaptation
2. Affinité - développement
3. Affinité - métabolismeb. CO2, pH : effet Bohr
c. température
d. autres facteurs
e. pigments respiratoires et diffusion de l'oxygène
Le sang exerce une fonction respiratoire chez la plupart des animaux, même chez de nombreuses espèces ne disposant pas de système respiratoire à proprement parler. Le sang sert en effet très souvent de transporteur d'O2 et de CO2, que ces gaz diffusent à travers un épithélium respiratoire spécialisé ou non. Chez les insectes par contre, où le système respiratoire est trachéen, le rôle du sang dans la respiration est souvent mineur, voir nul (voir chapitre 3).
Dans la plupart des cas, l'oxygène n'est pas que dissout dans le sang ; il est fixé sur des molécules particulières servant de transporteurs, augmentant ainsi largement la quantité d'O2 pouvant se trouver dans un volume donné de sang (pouvoir oxyphorique). Ce n'est pas le cas pour le CO2 qui lui est transporté dans le sang largement sous forme de HCO-3.
Dans cette section, nous envisagerons successivement les modalités du transport d'oxygène et de dioxyde de carbone au niveau sanguin.
Chez la plupart des animaux, la quantité d'oxygène dissoute dans le sang ne représente qu'une très petite partie de l'oxygène effectivement transporté par celui-ci. Chez l'homme par exemple et considérant une pression partielle d'oxygène dans le sang artériel de 95 mmHg, elle sera de 0,3 volume pour 100 (loi de Henry)
![]()
La quantité totale d'O2 que l'on peut extraire de ce même sang représente environ 20 volumes pour 100, soit environ 65 fois plus. En fait, l'essentiel de l'oxygène se trouve fixé au niveau d'une molécule transporteuse, en l'occurrence chez l'homme, l'hémoglobine. Ces molécules transporteuses, variables suivant les espèces, vont donc avoir pour rôle essentiel d'augmenter la capacité de charge du sang en O2.
1.2.1. Les transporteurs d'oxygène
Les transporteurs d'oxygène connus à l'heure actuelle sont au nombre de quatre (voir Il
s'agit de tableau 4-1). structures protéiques comportant un atome
métallique qui est directement impliqué dans la fixation de l'O2. Ces
molécules sont diversement colorées, ce qui leurs a valu leur nom de pigments
respiratoires.
Tableau 4-1
Les pigments respiratoires des animaux
| Chlorocruorine Couleur: verte PM 2.750.000 Structure: protéine - porphyrine - fer Toujours en solution Sabellidæ, Serpulidæ, Chlorhæmidæ, Ampharetidæ Hémérythrine Couleur: rouge-violacé PM 108.000 Structure: protéine contenant du fer Toujours dans des cellules sanguines Sipunculiens, Priapulides, Brachiopodes, certains polychætes Hémocyanine Couleur: bleu PM 300.000 à 9.000.000 Structure: protéine contenant du cuivre Toujours en solution Nombreux mollusques et crustacés, arachnomorphes |
Hémoglobine Couleur: rouge Structure: protéine - porphyrine - fer En solution ou dans des cellules : Dans des cellules sanguines Cyclostomes PM 19-23.000 Tous les autres vertébrés PM 68.000 Différents invertébrés PM 23-36.000 En solution Différents invertébrés PM 1,5 à 3.000.000 Larve de Chironome PM 31.000 Myoglobine intracellulaire PM 17.000 |
L'hémoglobine est le pigment respiratoire de tous les vertébrés. Elle est chez eux contenue dans des globules rouges, cellules auxquelles elle donne sa couleur. Ces cellules sont aussi appelées hématies ou érythrocytes. L'hémoglobine est également présente chez de nombreux invertébrés, soit dans des cellules sanguines, soit en solution dans le sang. L'atome métallique intervenant dans la fixation de l'O2 est ici le fer. Chez les vertébrés, les hémoglobines sont formées de l'association d'un nombre variable de monomères constitués d'une protéine, la globine, associée à un héme ( figure 4-1).
L'héme est le groupement prosthétique commun aux diverses hémoglobines (alors que la globine varie d'une hémoglobine à l'autre). C'est une protoporphyrine à laquelle est liée un atome de fer ferreux par coordination à ses 4 azotes pyrroliques. Le fer reste à l'état ferreux lors de la fixation d'O2. Cette fixation ne procède donc pas d'une oxydation telle que celle qui a lieu à l'intervention d'oxydants puissants au cours de laquelle l'hémoglobine se transforme en méthémoglobine et perd la capacité de se combiner réversiblement à l'oxygène. Le CO peut se fixer réversiblement à l'hémoglobine, tout comme l'O2, mais avec une affinité supérieure. Il est donc extrêmement nocif puisqu'il provoque une diminution considérable du pouvoir oxyphorique.
La globine est la partie protéique de l'hémoglobine. Des téléostéens aux mammifères, les hémoglobines sont des tétramères résultant de l'association de 4 chaînes polypeptidiques combinée chacune à un héme. Leur poids moléculaire est de 68.000. Chez l'homme adulte, on distingue deux chaînes a et deux chaînes b (figure 4-1). Chez les cyclostomes et différents invertébrés, il n'y aurait qu'une seule chaîne polypeptidique. On trouve également une hémoglobine de faible poids moléculaire (17.000) avec une seule chaîne protéique dans les muscles de différentes espèces, vertébrés comme invertébrés : la myoglobine.
La chlorocruorine est un autre pigment respiratoire porphyrique contenant du fer. Elle est de couleur verte avec un poids moléculaire de 2.750.000. Elle est limitée à 4 familles de polychætes : sabellidæ, serpulidæ, chlorhæmidæ et ampharetidæ. La chlorocruorine est toujours en solution dans le plasma. On ne la trouve jamais dans des cellules.
Les deux pigments respiratoires restants, l'hémérythrine et l'hémocyanine, sont non-porphyriques. L'hémérythrine est un pigment rouge-violet lorsqu'il est oxygéné et incolore lorsqu'il ne l'est pas. Contenant du fer et de poids moléculaire 108.000, il n'existe pas en solution. On le trouve dans des cœlomocytes chez les sipunculiens, les priapulides, les brachiopodes et quelques polychætes. L'hémocyanine est le pigment respiratoire de nombreux mollusques, crustacés et arachnomorphes. D'un poids moléculaire variant de 300.000 à 9.000.000, elle est bleue et n'existe qu'en solution.
1.2.2. Propriétés des transporteurs
a. pouvoir oxyphorique - affinité
La charge en oxygène du sang va dépendre de la quantité de molécules
transporteuses qu'il contient et aussi de l'affinité de ces molécules pour l'oxygène
ainsi que de la concentration (pression partielle) de l'O2 dans le sang. La
figure 4-2 montre, à titre d'exemple, la relation qui existe entre la
concentration en O2 du milieu et la pression partielle de l'O2 dans
le sang chez un mammifère. Comme on le voit, la quantité d'O2 totale fait
intervenir une fraction d'O2 dissout dans le plasma sanguin et une fraction,
largement plus importante, d'O2 lié à un transporteur (ici l'hémoglobine).
La fraction O2 dissout augmente régulièrement avec l'augmentation de la
pression artérielle en O2 (loi de Henry) alors de la fraction O2 de
l'hémoglobine montre une cinétique à saturation avec un plateau aux environs de 20
volumes %. La quantité d'O2 totale prise en charge par le sang en conditions
de saturation définit ce qu'il est convenu d'appeler le pouvoir oxyphorique du sang. Le
pouvoir oxyphorique est évidemment variable en fonction de la concentration du
transporteur d'O2 présent dans le sang. Chez les vertébrés, il parait
augmenter avec l'évolution, passant de 5-6 ml O2/100 ml de sang chez les
sélaciens à 8-12 chez les reptiles et 15 à 20 ou plus chez les mammifères. Il parait
par ailleurs variable avec le niveau d'activité de l'espèce. Il sera par exemple plus
élevé chez le maquereau, poisson pélagique bon nageur que chez le poisson crapaud,
poisson de fond se déplaçant peu ou chez la langouste que chez le tourteau, également
appelé crabe dormeur.
En considérant la quantité d'O2 maximum fixée sur le transporteur comme égale à 100 %, on peut exprimer la teneur en O2 en % de la saturation. On obtient ainsi des courbes exprimant le degré de saturation du transporteur pour l'oxygène en fonction de différents paramètres, pression partielle du milieu en O2 notamment (cfr. figure 4-2).
Dans ce dernier cas, on remarque que la cinétique est d'allure sigmoïde, indiquant une modification d'affinité apparente de l'hémoglobine pour l'O2 en fonction de sa disponibilité dans le milieu. Cet effet est en fait dû à la prise en charge de l'O2 sur les sous-unités constitutives de l'hémoglobine suivant un mode coopératif. Notons par ailleurs que la pression partielle en O2 du sang artériel est de 95 mmHg alors que celle du sang veineux n'est que de 40 mmHg. La charge du sang en oxygène sera donc plus importante dans le sang artériel que dans le sang veineux ou, en d'autres termes, le sang artériel arrivant aux tissus pourra relarguer une certaine quantité d'oxygène. Il est intéressant de noter ici que les changements d'affinité en fonction de la teneur en O2 du milieu vont favoriser le relarguage de l'O2 aux tissus en conditions physiologiques comme le montre le schéma de la figure 4-3. Il est clair dans ce contexte que la plus ou moins bonne capacité à délivrer l'oxygène aux tissus ou à fixer l'oxygène au niveau des échangeurs respiratoires dépendra de l'affinité du transporteur pour l'O2 mais également de la pression partielle en O2 prévalant localement. Elle sera aussi fonction d'autres paramètres, comme la teneur en CO2 du sang ou sa température (voir plus loin) mais aussi la vitesse d'écoulement et les possibilités de diffusion. Dans ce cadre, ce serait une erreur de croire que le sang d'un organisme délivrera l'entièreté de l'oxygène qu'il contient aux tissus. Le relarguage au niveau tissulaire tout comme d'ailleurs la charge au niveau respiratoire seront en effet fonction non seulement de l'affinité du transporteur pour l'O2 mais encore des surfaces de diffusion et des gradients en O2 existants ainsi que de la vitesse de perfusion des organes ; ces paramètres étant eux-mêmes variables en fonction de nombreux facteurs. Ainsi chez l'homme au repos par exemple, si l'hémoglobine est saturée à 95-97 % au niveau pulmonaire, elle n'est désaturée que de 25 à 40 % au niveau des tissus. Ces dernières valeurs sont éminemment variables, dépendant de la demande énergétique de l'organe envisagé ; en moyenne l'hémoglobine dans le sang veineux de retour reste saturée à près de 70 % ; ce qui laisse une marge importante permettant de répondre à une forte demande.
L'étude des courbes de dissociations de l'O2 dans le sang, telle que celle reprise à la figure 4-2, met en évidence quelques propriétés des transporteurs intéressantes au plan physiologique. Ces propriétés sont en rapport avec des modifications de l'affinité des pigments respiratoires pour l'oxygène qui sont soit génétiquement fixées, soit fonction des conditions du milieu.
1. Affinité - adaptation
La capacité à délivrer l'oxygène de même que l'affinité peuvent être exprimée
par la PO2 à laquelle on obtient 50 % de la saturation (P50). Les valeurs de
P50 de quelques hémoglobines sont données à titre exemplatif dans le tableau
4-2.
Tableau 4-2
PO2 correspondant à 50 % de la saturation (P50) pour différentes
hémoglobines
| Chironome Arénicole Carpe Truite Saumon |
0,5 1,8 5 18 19 |
Grenouille Pigeon Eléphant Homme Souris |
13 35 22 28 45 |
Comme on le voit, l'affinité pour l'O2 est nettement supérieure chez des espèces vivant en milieux pauvres en O2 (arénicole, carpe) que chez les autres. En général, les valeurs de P50 seront d'autant plus faibles et les courbes de dissociations plus à gauche, traduisant donc une plus haute affinité du pigment respiratoire pour l'O2, que les animaux vivront dans des milieux ou la disponibilité en oxygène est basse. Comparez dans ce cadre les courbes de dissociation obtenues pour le sang de mammifères des hauts plateaux andins et celles obtenues pour d'autres espèces (figure 4-4), du têtard de grenouille et de l'adulte (figure 4-5) ou de différents crustacés vivants dans des milieux où la disponibilité en O2 peut être très différente ( figure 4-6). De même, deux espèces vivant dans un même milieu mais utilisant des systèmes respiratoires diversement efficaces pourront présenter des courbes de dissociation tout à fait différentes. Ainsi chez deux poissons amazoniens, l'hémoglobine présente une affinité pour l'O2 plus élevée chez une espèce strictement aquatique que chez une autre pratiquant une respiration bimodale avec respiration aérienne obligatoire (figure 4-7). Une telle diminution d'affinité paraît de règle chez tous les poissons à respiration bimodale tirant avantage de la grande disponibilité de l'O2 dans le milieu aérien. A l'inverse, une augmentation d'affinité de l'hémocyanine pour l'O2 parait accompagner la transition vers le milieu terrestre chez les crustacés. Cette différence entre poissons et crustacés reste à ce jour inexpliquée. Peut être faut-il y voir le reflet d'une différence importante d'efficacité entre les organes de respiration aérienne des poissons et ceux des crustacés.
 |
Figure 4-4: Courbes de dissociation de l'oxygène du sang de deux mammifères d'altitude par rapport à celles d'autres mammifères. |
 |
Figure 4-5: Courbes de dissociation de l'oxygène du sang du têtard de grenouille par rapport à l'adulte. Courbes plus à gauche et effet Bohr moins marqué. |
2. Affinité - développement
En général, les premiers stades du développement animal s'effectuent dans des
micro-environnements au niveau desquels la tension en O2 peut devenir
relativement basse. Il est intéressant de remarquer dans ce contexte que les courbes de
dissociation de l'O2 du sang traduisent en général une affinité du
transporteur plus élevée chez l'embryon que chez l'adulte. Ce phénomène, illustré
figure 4-8 dans le cas du poisson vivipare Zoarces viviparus, a
été mis en évidence dans les différents groupes de vertébrés, poissons, amphibiens,
reptiles, oiseaux et mammifères, y compris l'homme et exception faite du chat. Il semble
que, dans la plupart des cas, la plus grande affinité pour l'O2 de
l'hémoglobine fœtale soit essentiellement structurelle. Chez l'homme par exemple,
les chaînes peptidiques de la globine sont différentes (g
chez le fœtus et b chez l'adulte). Ce n'est cependant pas
toujours le cas. Chez différents amphibiens comme chez certains mammifères tels que
cheval, chien, lapin ou souris, l'augmentation d'affinité peut être mise en rapport avec
une concentration nettement inférieure des hématies en 2,3 diphosphoglycerate (voir
d ci-après).
 |
Figure 4-8: Courbes de dissociation de l'oxygène du sang maternel et fœtal chez le poisson téléostéen vivipare Zoarces viviparus à 10 et 20 °C. |
3. Affinité - métabolisme
Comme nous l'avons signalé précédemment (chapitre 3), les besoins métaboliques
d'une espèce de petite taille sont proportionnellement plus importants que ceux d'une
grande au sein d'un même groupe zoologique. Il est intéressant de remarquer dans ce
cadre que les points d'inflexion des courbes de dissociation de l'oxygène sont déplacés
vers la droite chez les mammifères de petite taille (figure 4-9). Ce
déplacement se traduit par une P50 plus élevée (tableau 4-2). Le
sang d'un petit mammifère a donc une affinité pour l'oxygène moins élevée que celui
d'un grand ; ce qui va se traduire par un meilleur relarguage de l'O2 au niveau
tissulaire. Une autre adaptation des petites espèces à leurs besoins métaboliques
concernant les apports d'O2 aux tissus, réside dans une augmentation de la
densité des capillaires sanguins, ce qui permet de réduire la distance de diffusion
entre les capillaires et les cellules les plus éloignées de ceux-ci.
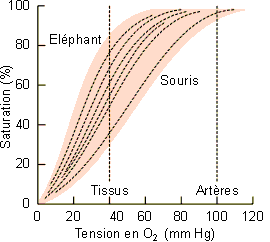 |
Figure 4-9: Courbes de dissociation de l'oxygène du sang de mammifères de différentes tailles, de l'éléphant à la souris. |
b. CO2, pH : effet Bohr
Les variations de pH sanguin ou de pression partielle en CO2 provoquent des
déplacements des courbes de dissociation de l'O2 dans le sang. Cet effet a
été mis en évidence pour la première fois en 1904 par Bohr, Hasselbalch et Krogh,
d'où le nom d'effet Bohr qu'il porte encore aujourd'hui. Comme le montre les figures
4-10 et 4-11 ainsi que 4-5 et
4-6, une augmentation de PCO2 ou une diminution de pH provoque
un déplacement plus ou moins marqué de la courbe vers la droite. Il y a donc un meilleur
relarguage de l'O2 au niveau tissulaire. Ce type d'effet est particulièrement
intéressant à considérer dans le cadre d'une activité musculaire importante, condition
amenant une augmentation notable de production de CO2 parfois accompagnée
d'une production d'acide lactique et dans laquelle la demande en oxygène augmente
largement.
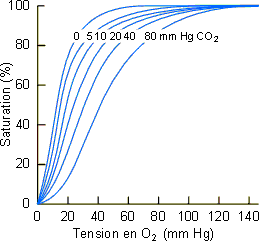
|
Figure 4-10: Reproduction du graphique original de Bohr, Hasselbalch et Krogh (1904) concernant l'effet de la PCO2 sur la courbe de dissociation de l'O2 du sang humain. |
Un effet Bohr a été mis en évidence au niveau des quatre pigments respiratoires connus et chez la plupart des espèces étudiées. Cet effet peut être très peu marqué, voire inexistant (sipunculiens, arénicole) ou même inversé (Busycon, limule). Ces cas particuliers se rencontrent chez des espèces ayant par ailleurs des courbes de dissociation de l'O2 très à gauche, indiquant une haute affinité du pigment respiratoire pour l'O2. Il s'agit en général d'espèces d'eaux stagnantes, à forte eutrophisation avec une faible teneur en O2 et souvent un pH variable et une haute teneur en CO2. Dans ces conditions, un effet Bohr trop marqué risquerait de nuire à la prise en charge d'O2 et/ou à son relarguage. Un effet Bohr inversé pourrait par contre faciliter la fixation d'O2 sur le pigment respiratoire. Ces considérations sont bien illustrées par l'allure des courbes de dissociation de l'O2 et l'importance de l'effet Bohr chez le têtard ou la grenouille adulte (figure 4-5) ou chez différents crustacés vivant dans des milieux à disponibilité en oxygène différente (figure 4-6).
Il est par ailleurs intéressant de remarquer que chez les mammifères, l'effet Bohr est d'autant plus important que l'espèce est de petite taille (figure 4-12). Ce phénomène est à mettre en rapport avec les besoins énergétiques plus élevés des espèces de petites tailles, un effet Bohr important signifiant un meilleur relarguage d'O2 aux tissus.
Figure 4-12: A: L'effet Bohr chez différents mammifères en fonction de leur taille. L'effet Bohr est ici donné par la différence de P50 mesurée sur les courbes de dissociation pour une variation de pH donnée comme l'indique le schéma conceptuel en B.
Chez certains poissons, l'effet du CO2 ou du pH est très nettement marqué. Le changement d'affinité de l'hémoglobine est tel que la courbe de dissociation s'aplatit pour ne même plus atteindre la saturation (figure 4-13). Ce phénomène est appelé effet Root, du nom du premier auteur de la publication le décrivant pour la première fois en 1939 (Root, Irving et Black). L'intérêt physiologique de l'effet Root n'est pas clair. Il semble qu'il puisse intervenir dans la sécrétion d'oxygène dans la vessie natatoire de certains poissons. Les cellules de la glande à gaz produisent en effet de l'acide lactique qui, en diminuant nettement l'affinité de l'hémoglobine pour l'O2, favorise son relarguage et son accumulation au niveau de l'organe.
c. température
La température exerce également un effet important sur les courbes de dissociation
de l'O2 du sang chez toutes les espèces où ce phénomène a été étudié (
figure 4-14, voir aussi figure 4-8). Il est
particulièrement intéressant pour les pœcilothermes. Chez ces espèces à
température corporelle variable, les besoins métaboliques sont en effet nettement plus
élevés en période chaude qu'en période froide (voir chapitre
3). Le déplacement de la courbe de dissociation vers la droite avec l'augmentation de
la température favorise le relarguage de l'O2 aux tissus en périodes de
demande énergétique plus grande.
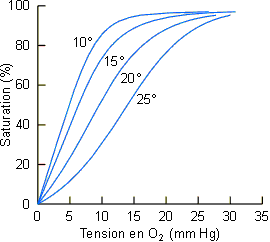 |
Figure 4-14: Effet de la température sur la courbe de dissociation de l'oxygène du sang du crustacé Palinurus interruptus (hémocyanine). |
L'importance des effets thermiques est souvent fonction des conditions d'adaptation chez les pœcilothermes. Ces problèmes seront envisagés plus en détail dans le chapitre 12. Considérons simplement ici deux exemples où ces effets sont très peu marqués. C'est le cas chez la blennie, petit poisson se retrouvant souvent à marée basse dans de petites mares où la température peut varier très largement dans des conditions peu compatibles avec une augmentation du métabolisme. C'est également le cas chez le thon. Comme nous le verrons par la suite, ce poisson possède au niveau de certaines masses musculaires un réseau vasculaire organisé en échangeur thermique (voir chapitre 12 ). Cet arrangement peut générer une différence allant jusqu'à 20 °C entre le sang artériel arrivant froid aux muscles et le sang veineux en sortant. On a pu calculer que si l'hémoglobine du thon était aussi sensible à la température que celles des autres poissons, la quantité d'O2 libérée au niveau de l'échangeur thermique lors du réchauffement du sang artériel serait suffisamment élevée pour provoquer un risque sérieux d'embolie gazeuse. En fait, le peu d'effet thermique empêche que l'O2 apporté par le sang ne soit court-circuité par le circuit veineux de l'échangeur avant d'atteindre le muscle.
d. autres facteurs
De nombreuses espèces de poissons ont à subir des périodes de diminution importante
de disponibilité en oxygène dans leur milieu. Dans ces conditions, on remarque souvent
une augmentation de l'affinité de l'hémoglobine pour l'O2 avec déplacement
de la courbe de dissociation de l'O2 vers la gauche, ce qui favorise la prise
en charge d'O2 au niveau respiratoire (figure 4-15). Cet
effet pourrait être en rapport, via une augmentation de pH intracellulaire, avec la
libération de catécholamines dans le sang observée dans ces conditions. Un phénomène
similaire s'observe suivant un rythme nycthéméral chez certaines espèces (poissons,
amphibiens) vivant dans des mares ou l'activité photosynthétique peut faire passer la PO2
du milieu de 400 mmHg le jour à 5 mmHg la nuit, lorsque la respiration des plantes
domine.
Le mode d'action des catécholamines sur l'affinité des hémoglobines de poissons reste à l'heure actuelle obscur. Il semble que l'effet puisse être mis en rapport, partiellement du moins, avec la baisse de concentration en ATP que provoquent ces hormones dans les globules rouges.
 |
Figure 4-15: Effet de l'adaptation de l'anguille à un milieu hypoxique sur la courbe de dissociation de l'oxygène du sang. |
D'autres phosphates organiques interviennent également dans la modulation de l'affinité des transporteurs pour l'O2. C'est le cas notamment du 2,3 diphosphoglycerate. Ce composé diminue l'affinité de l'hémoglobine pour l'O2 chez différents vertébrés : amphibiens, certains reptiles mais surtout mammifères. Cet effet favorise la libération d'O2 aux tissus, il joue un rôle dans l'adaptation des mammifères à des milieux pauvres en oxygène (haute altitude : voir plus loin). Le 2,3 DPG est synthétisé dans les globules rouges à partir d'un intermédiaire de la glycolyse. On connaît mal à l'heure actuelle les mécanismes qui contrôlent sa concentration.
e. pigments respiratoires et diffusion de l'oxygène
Scholander découvrit en 1960 une propriété inattendue de l'hémoglobine concernant
la diffusion de l'oxygène dans une solution (Science, 131, 585). La présence
d'hémoglobine accélère en fait considérablement la diffusion de l'O2 dans
les milieux aqueux. Cette diffusion "facilitée" parait associée à la
propriété des pigments respiratoires de fixer réversiblement l'O2. Elle est
d'autant plus marquée que la pression partielle de l'O2 dans le milieu est
basse et que le poids moléculaire du pigment est faible. Cet effet est dès lors
pratiquement non significatif avec les pigments de haut poids moléculaire tels
qu'hémocyanine ou chlorocruorine. Il est par contre particulièrement important avec la
myoglobine, hémoglobine monomérique de 17.000 de poids moléculaire, que l'on trouve
dans les muscles, au niveau desquels la pression partielle de l'O2 peut devenir
très basse.
Ces considérations permettent de mieux comprendre le "succès" de l'hémoglobine comme pigment respiratoire. On retrouve en effet ce pigment chez de très nombreuses espèces : tous les vertébrés mais aussi chez de nombreux invertébrés et particulièrement chez des espèces vivant dans des milieux pauvres en oxygène (Ascaris, larve de chironome...). Par ailleurs, le rôle que peut jouer une hémoglobine de faible poids moléculaire dans la diffusion de l'O2 au niveau tissulaire permet d'expliquer la présence de myoglobine au niveau des muscles de certains invertébrés comme le chiton par exemple alors que leur pigment respiratoire sanguin est l'hémocyanine.
Contrairement à ce qui se passe pour l'oxygène, il n'existe pas de transporteur fixant de façon spécifique le CO2 dans le sang. Le CO2 va donc se retrouver, pour une petite part, sous forme libre, dissout dans le plasma et le liquide intracellulaire des éléments figurés sanguin. Chez les vertébrés, cette fraction est loin d'être négligeable puisque ces éléments, avec parmi eux essentiellement les globules rouges, peuvent représenter quelque 40 % du volume sanguin total. Une autre petite partie du CO2 sera fixée aux protéines du plasma ou des globules rouges, essentiellement l'hémoglobine dans ce dernier cas. Il s'agit ici d'une liaison carbamino-protéique faisant intervenir les groupements N terminaux :
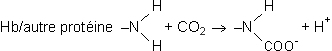
L'essentiel du CO2 (90 % chez l'homme, tableau 4-3) se trouve en fait sous forme de bicarbonate dans le plasma et les globules rouges ( figure 4-16).
Tableau 4-3
Distribution du CO2 sanguin chez l'homme, en % du total
| Plasma | Globules rouges | |
| HCO3- | ~ 60 | ~ 30 |
| CO2 | ~ 3 | ~ 2 |
| Carbamino-P | ~ 2-3 | ~ 2-3 |
Figure 4-16: Transport de CO2 dans le sang des mammifères. AC*: anhydrase carbonique favorisant la formation de HCO3– dans les hématies, HbCO2*: carbamino hémoglobine, Prot CO2*: carbamino protéine.
Un point remarquable concernant la liaison du CO2 à l'hémoglobine est le fait que l'hémoglobine désoxygénée peut fixer plus de CO2 que l'hémoglobine oxygénée (figure 4-17). Ce phénomène, connu sous le nom d'effet Haldane présente un certain intérêt physiologique puisque l'hémoglobine ayant déchargé une partie de son oxygène au niveau des tissus pourra fixer plus de CO2. Ce CO2 sera par contre libéré plus facilement au niveau des échangeurs respiratoires, l'hémoglobine se chargeant en oxygène.