L'assimilation des nutriments et leur oxydation au niveau cellulaire permet l'alimentation des cellules en énergie et en matériaux indispensables à leurs activités. (Cfr. chapitre 3). Ce qui n'est pas utilisé directement participe à la formation de produits de réserve qui seront stockés pour utilisation ultérieure.
Nous distinguerons trois types de composés de réserve selon la plus ou moins grande rapidité et les modalités du transfert de l'énergie stockée au système utilisateur. Nous envisagerons ainsi : 1) des composés à liaison phosphate riche à partir desquels le transfert d'énergie est extrêmement rapide; 2) des composés glucidiques et lipidiques, la plupart du temps de haut poids moléculaire et dont l'utilisation est dès lors assez lente, mettant en jeu des séquences métaboliques relativement longue.
Les premières formes de mise en réserve de l'énergie d'oxydation des nutriments dans le métabolisme oxydatif sont l'ATP et quelques autres esters-phosphate à liaison riche (UTP, GTP). Ces composés ne sont pas en concentration élevée dans les cellules et ne peuvent guère être considérés comme des éléments de réserve. Dans les muscles, dont l'activité de contraction demande beaucoup d'énergie, le groupement phosphoryl riche en énergie de ces composés peut être transféré et mis en réserve sur certaines molécules qui forment le groupe des phosphagènes. Ces phosphagènes constituent donc une réserve d'énergie qui peut être mise très rapidement à disposition du système contractile (cfr. chapitre 7), en attendant que la stimulation de la glycolyse se traduise par une formation accrue d'ATP (voir réserves glucidiques ci-après). La mise à disposition d'énergie et la rephosphorylation des phosphagènes se fait dans le cadre d'une réaction du type général illustré figure 5-35 (réaction de Lohman).
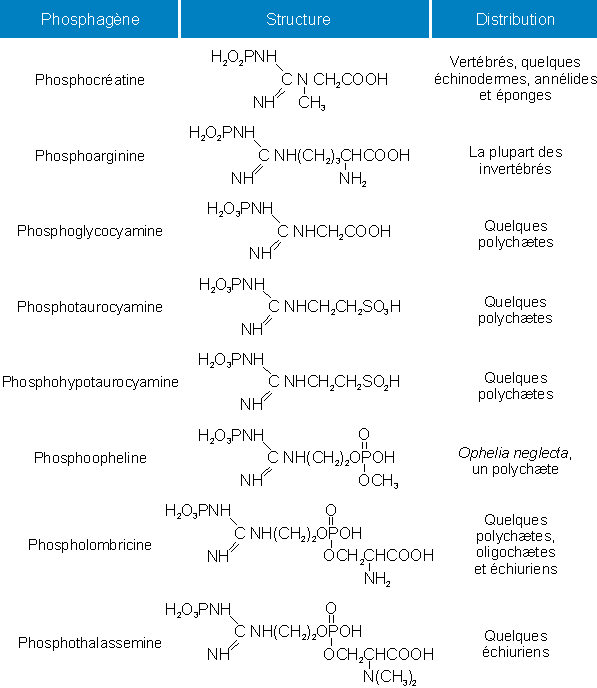
La phosphocréatine constitue l'essentiel de ce type de réserve chez les vertébrés. On en trouve également chez différentes espèces d'échinodermes, d'annélides et d'éponges. Ce n'est toutefois pas le phosphagène majeur des invertébrés qui utilisent surtout la phosphoarginine. Certaines annélides utilisent des composés tels la phosphoophéline chez l'Ophélie ou la phospholombricine chez le lombric et quelques autres oligochætes. On trouvera de la phosphothalassemine chez certains échiuriens ( tableau 5-4).
Tableau 5-4
Quelques phosphagènes des muscles de différents animaux
Chez les animaux, le composé de réserve glucidique essentiel est le glycogène, un polymère de glucose pouvant semble-t-il être synthétisé par tous les types cellulaires mais stocker essentiellement dans le foie chez les vertébrés, l'hépatopancréas chez différents invertébrés et les insectes. Dans les muscles, il intervient pour fournir l'énergie nécessaire à la contraction. Les réserves hépatiques peuvent être mobilisées en cas de besoin en énergie de l'organisme. Cette mobilisation est essentiellement sous contrôle hormonal (voir chapitre 8).
Un avantage majeur du glycogène par rapport aux lipides de réserves, essentiellement des triglycérides, est qu'il peut être utilisé à la fourniture d'ATP en anaérobie (cfr. chapitre 3). Les muscles pourront donc continuer de fonctionner même lorsque les apports en O2 deviennent insuffisants pour permettre le maintien d'un métabolisme oxydatif aérobie. Cette particularité fait par ailleurs du glycogène le composé de réserve de choix des animaux anaérobies stricts (vers parasites, etc.) ou facultatifs (mollusques intertidaux, etc. qui doivent vivre en permanence ou périodiquement sans oxygène. Chez ces espèces, la fin de la glycolyse anaérobie est d'ailleurs différente de ce qu'elle est au niveau des muscles, ce qui permet un meilleur rendement énergétique comme nous l'avons vu au chapitre 3.
L'oxydation d'un gramme de glycogène fournit 4,2 kcal; un peu moins de la moitié de ce que fournit un gramme de triglycérides (9,4 kcal, chapitre 3). Le glycogène est par ailleurs une molécule hydrophile, à l'inverse des triglycérides, et est mis en réserve sous forme hydratée : dans ces conditions, son oxydation ne fournit plus que 1,5 kcal/g. Pour un même contenu énergétique, une réserve de glycogène sera donc beaucoup plus lourde qu'une réserve de triglycérides. Ceci constitue un désavantage majeur du glycogène comme composé de réserve.
Comme nous l'avons déjà signalé, la fourniture d'énergie au système musculaire à partir des réserves de glycogène implique la stimulation d'une séquence métabolique relativement longue; l'apport en ATP venant de cette source n'est donc pas immédiat. La présence de différents phosphagènes permet de résoudre le problème dans la plupart des cas. Différents insectes stockent par ailleurs du tréhalose (un dimère de glucose) ou de la proline (un acide aminé). La proline intervient comme source énergétique "de première ligne", pour rencontrer l'importante demande énergétique des muscles alaires, tout au début du vol chez certaines espèces. L'avantage de la proline est de donner très rapidement, dans une courte séquence métabolique, de l' a -cétoglutarate, un substrat du cycle de Krebs qui peut être oxydé immédiatement. Dans ce mécanisme, l'oxaloacétate, dérivé de la proline dans le cycle de Krebs, fournit l'acétyl CoA nécessaire à sa condensation en citrate via le phosphoénolpyruvate (figure 5-36). Le système peut donc fonctionner sans intervention immédiate de glucose. C'est à notre connaissance le seul cas où un composé aminé est utilisé comme réserve énergétique. En général, protéines et acides aminés ne sont guère utilisés à cette fin. La consommation des protéines à des fins énergétiques n'intervient en effet qu'en dernier recours, lorsque les réserves glucidiques et lipidiques sont épuisées.
 |
Figure 5-36: La proline comme réserve énergétique au niveau des muscles du vol chez certains insectes. |
Les réserves lipidiques sont essentiellement constituées de triglycérides. Leur seul désavantage par rapport au glycogène est qu'ils ne peuvent être mobilisés que dans une séquence aérobie; ce qui exclut leur utilisation en l'absence d'oxygène. Ils présentent par contre l'avantage majeur d'être beaucoup plus énergétiques que le glycogène par unité de poids (9,4 kcal/g contre 1,5; voir chapitre 3 et 6.2 ci-avant). Leur pouvoir isolant constitue un autre avantage qui fera d'eux des éléments de réserve de choix pour les animaux des régions froides (voir chapitre 11).
En général, glycogène et triglycérides participent ensemble à la formation de réserves énergétiques chez les animaux. Les proportions de ces deux éléments varient en fonction de l'organisme, de son activité, parfois de la période de l'année, etc.
Ainsi, les animaux anaérobies ou anaérobies facultatifs (vers parasites, mollusques intertidaux) vont stocker essentiellement du glycogène. Les animaux ayant à se mouvoir beaucoup choisiront plutôt les lipides pour le gain de poids qu'ils représentent par rapport au glycogène dans une réserve de même niveau énergétique. C'est le cas des camélidés et des oiseaux migrateurs dont certaines espèces accumuleront jusqu'à 50 % de leur poids sous forme de graisses en période pré-migratoire. Les criquets migrateurs diminuent largement les réserves de glycogène au profit de réserves lipidiques en période pré-migratoire. Le gain de poids que permettent les réserves lipidiques font que dans la plupart des cas, celles-ci sont largement supérieures aux réserves glucidiques, de 10 à 50 fois plus chez l'homme par exemple qui pour 1 kg de glycogène stocké aura 10 à 15 kg de réserves de graisses. Par ailleurs, les homéothermes terrestres de régions froides et plus encore les aquatiques, utiliseront largement d'importantes réserves de graisses sous-cutanées comme isolant thermique.
Chez les vertébrés, les graisses de réserve sont stockées préférentiellement dans le foie et surtout dans des adipocytes, cellules particulières formant le tissu adipeux. On trouve également des gouttelettes lipidiques dispersées dans différents types cellulaires, notamment dans les cellules musculaires. Dans cette dernière localisation, on les trouve essentiellement associées aux mitochondries où elles sont proches de nombreux granules de glycogène (figure 5-37). Les deux types de réserves seront ici utilisés lors de la contraction musculaire (voir plus loin).
Le tissu adipeux constitue évidemment la réserve lipidique la plus importante. Ce tissu adipeux est essentiellement sous-cutané. Dans cette localisation, il sert d'antichoc et d'isolant thermique; il peut par ailleurs former des zones d'accumulation de graisses à différents endroits (fesses, épaules, bosses du chameau...). Les lipides de réserve du tissu adipeux ne sont pas utilisés sur place ; ils sont remis en circulation pour être utilisés par les différents organes en fonction de leurs besoins énergétiques. Certaines espèces, cependant, homéothermes hibernants notamment, possèdent des réserves de lipides particulières mobilisables sur place, essentiellement dans le cadre d'une production de chaleur (voir chapitre 12). Ces réserves constituent le tissu adipeux brun ainsi appelé à cause de la coloration brunâtre que lui procure un nombre élevé de capillaires sanguins et une haute densité de cytochromes mitochondriaux. Le bébé humain possède quelques réserves lipidiques ( ± 5 % du total) dans un tissu adipeux brun localisé essentiellement dans la région du cou et de l'abdomen. L'utilisation de ce tissu pallie chez le nouveau né au manque d'efficacité des autres mécanismes de thermorégulation (frisson, activité musculaire : voir chapitre 12).
Le glycogène est essentiellement stocké dans le foie et dans les muscles où il peut être utilisé directement à l'énergétique de la contraction. Dans le foie, il sert de donneur de glucose pour l'ensemble de l'organisme. Le foie présente la particularité de pouvoir effectuer la néoglucogenèse. C'est en effet le seul organe à pouvoir effectuer la synthèse du glucose à partir de substrats du métabolisme intermédiaire tels que lactate provenant du métabolisme musculaire anaérobie, pyruvate, oxaloacétate ou a -cétoglutarate produits dans les séquences de l'excrétion azotée (voir chapitre 6). Le foie peut ainsi contrôler le niveau de glucose sanguin (glycémie) en régulant son activité de synthèse de glucose (néoglucogenèse), de synthèse (glycogenèse) ou de dégradation (glycogénolyse) du glycogène (figure 5-38). Cette activité est essentiellement sous contrôle hormonal (cfr. chapitre 8).
Figure 5-38: Le foie, la gestion des réserves de glycogène et de glucose sanguin. Le lactate pouvant être produit dans les muscles en anaérobie peut être utilisé dans le foie à la synthèse de glucose qui, soit est utilisé à la synthèse de glycogène de réserve dans les hépatocytes, soit est déversé dans le sang d'où il peut être réutilisé à la synthèse de glycogène dans les muscles (cycle de Cori). Les groupements NH2 provenant de la dégradation des protéines sont stockés dans les tissus sous forme de glutamine et de quelques autres composés "transporteurs" comme l'alanine, l'aspartate et le glutamate. Les groupements NH2 de ces composés sont utilisés dans le foie à la synthèse d'urée qui passe dans le sang et est éliminée par le rein. Les squelettes hydrocarbonés peuvent eux être utilisés à la synthèse de glucose et de glycogène (voir chapitre 6).
Il semble que les lipides et le glycogène stockés dans les muscles soient utilisés préférentiellement à des composés circulants lors de l'effort. Des études montrent en effet que chez le chien soumis à un exercice augmentant d'intensité, l'utilisation des glucides devient plus importante que celle des lipides qui diminue (figure 5-39). On remarque par ailleurs que c'est essentiellement l'utilisation du glycogène musculaire qui augmente : la participation du glucose sanguin à la fourniture d'énergie ne varie que peu.
Figure 5-39: Taux d'oxydation de différents composés chez le chien au cours d'exercices d'intensités différentes. A: Glucose circulant, glycogène musculaire et lipides totaux. Les taux d'oxydation sont ici rapportés à la part de la consommation d'oxygène qu'ils induisent. B: Acides gras circulants et musculaires - glucides totaux. Les taux d'oxydation sont ici exprimés en % de la consommation d'oxygène totale. Les intensités d'exercice rapportées en A et B sont exprimées en % de l'intensité maximum.
Chez les invertébrés, les sites de stockage des éléments de réserve restent mal étudiés. On peut trouver certains de ces éléments en concentrations très élevées dans des endroits particuliers, variables suivant les groupes. On trouvera ainsi par exemple du glycogène dans le manteau des lamellibranches ou dans le septum central des branchies des crustacés (figure 5-40). Dans cette dernière localisation, il peut être directement utilisable à l'énergétique des transports ioniques en rapport avec l'osmorégulation.
Figure 5-40: Vue en microscopie électronique d'une section de branchie postérieure du crabe chinois Eriocheir sinensis. A: Faible grossissement. B: Fort grossissement du tissu du septum central; les très nombreux grains nettement visibles sont des grains de glycogène. (SC: septum central, LS: lacune sanguine).
Le contrôle des réserves glucidiques et lipidiques reste extrêmement mal connu. Il fait intervenir des facteurs nerveux et hormonaux qui seront envisagés dans les chapitres consacrés à ces systèmes (8 et 9). Récemment, l'hypothèse d'un facteur génétique d'obésité a repris de l'intérêt. Cette idée date des années cinquante, époque à laquelle apparaît dans un laboratoire américain, par mutation naturelle, une souche de souris obèses, stockant les graisses de manière anormale. Diverses expériences effectuées sur ces souris indiquent qu'un facteur protéique Ob, également appelé leptine, sécrété à partir des cellules adipeuses, influence l'activité d'un "lipostat" hypothalamique qui contrôlerait en rétroaction le niveau des réserves lipidiques en agissant sur l'ingestion d'une part et le métabolisme énergétique (production de chaleur, activité mitochondriale) d'autre part, de façon à réguler le niveau global des réserves. Dans ce cadre, on considère actuellement que la leptine sécrétée par la masse adipeuse en fonction de son volume aurait un double effet au niveau de différents centres hypothalamiques (figure 5-41). Elle inhiberait d’une part la production d’un neuropeptide Y (NPY) qui agit normalement de façon positive sur les mécanismes de balance nutritionnelle à long terme. NPY stimulerait en effet la prise de nourriture en même temps que la production d’insuline pancréatique, ce facteur hormonal stimulant lui-même la métabolisation du glucose en lipides notamment (voir chapitre 9). NPY augmenterait par ailleurs le tonus parasympathique et diminuerait les dépenses énergétiques. La leptine stimulerait d’autre part la production d’autres neuropeptides hormonaux tels que ART, MSH et CRH ayant pour effet de diminuer la prise de nourriture et d’augmenter le tonus sympathique ainsi que les dépenses énergétiques. Il est clair que dans ce schéma, une augmentation de leptine aboutit à une régression de la masse adipeuse et à l’inverse une diminution de sa concentration est favorable à une augmentation de cette masse. Il semble que les souris mutantes de type Ob ne possèdent pas le gène codant la leptine et soient, dès lors, incapables de la synthétiser. Cette protéine ne parait pas faire défaut chez l'homme obèse. Les mécanismes de l'embonpoint chez lui se rapprocheraient plutôt de ceux observés sur une autre lignée de souris obèses, appelée db. Ces souris ne manquent pas de leptine mais plutôt des récepteurs hypothalamiques sur lesquels elle se fixe. Les recherches sur la protéine Ob et sur l'identification de son récepteur hypothalamique à des fins pharmaceutiques font à l'heure actuelle l'objet d'un énorme marché commercial.
Figure 5-41 : Schéma hypothétique mettant en évidence la participation de la leptine au contrôle de la masse adipeuse.