
2.2.1. Formation d'urée
2.2.2. Formation d'acide urique
2.2.3. Autres voies
Les composés azotés majeurs que l'on trouve au sein des organismes animaux sont les protéines, les acides nucléiques et les porphyrines formant le groupement prosthétique des hémoglobines notamment.
Les protéines constituent de loin la catégorie la plus importante, du moins en termes quantitatifs. Curieusement, il n'existe pour les substances azotées servant de base à la synthèse de ces molécules aucune forme de stockage, comme il en existe pour les acides gras et les glucides par exemple. Les protéines sont donc continuellement renouvelées à partir d'acides aminés dont la concentration est maintenue à des niveaux assez bas dans un système métabolique où la dégradation joue un rôle important (voir plus loin et aussi figure 6-7). Dans ce contexte, les squelettes hydrocarbonés des acides aminés rejoignent le pool des produits du métabolisme intermédiaire alors que les groupements NH2 se retrouvent essentiellement sous forme d'ammoniac que les animaux tolèrent apparemment mal et qui est éliminé sous différentes formes (figure 6-7).
Les bases puriques et pyrimidiques provenant des acides nucléiques peuvent également donner du NH3. Les porphyrines sont importantes en ce qu'elles forment le groupement prosthétique des hémoglobines. Comme nous l'avons vu précédemment l'azote est ici éliminé essentiellement sous forme d'urobiline et de stercobiline (voir 1.3 ci-avant).
Figure 6-7: Catabolisme des composés azotés (protéines, acides nucléiques, porphyrines) et non azotés (glucides, lipides) majeurs. AA: acides aminés.
La toxicité de l'ammoniac fait partie des dogmes fondamentaux concernant l'excrétion azotée; elle reste cependant fort mal comprise. Diverses hypothèses ont été proposées qui, probablement, contiennent chacune une part de vérité. Elles font intervenir 1) des effets directs sur les concentrations en acides aminés et sur certains produits dérivés tels que glutamate, glutamine et acide g -aminobutyrique qui pourraient avoir des effets toxiques notamment sur le système nerveux; 2) des effets de pH, l'ammoniac est en effet une base dont les effets alcalinisant peuvent affecter les activités cellulaires; 3) des effets sur le contrôle du pool des ions hydrogène et dès lors sur l'activité mitochondriale notamment. Dans ce cadre, des travaux déjà anciens montrent que l'ammoniac peut avoir des effets de découplant des phosphorylations aussi bien chez les plantes (Crofts, J. Biol. Chem., 242, 3352, 1967) que chez les animaux (Brierley et Stoner, Biochem., 9, 708, 1970). On pourrait également ajouter des effets sur les équilibres ioniques intracellulaires, le NH4+ étant un excellent substituant du K+ pour l'ATPase gérant les échanges membranaires Na+/K+ (voir physiologie cellulaire).
La première étape du catabolisme des protéines consiste en la libération des acides aminés constitutifs par hydrolyse des liaisons peptidiques. Les acides aminés sont ensuite désaminés et les squelettes hydrocarbonés restants utilisés dans le métabolisme.
La désamination peut s'effectuer de différentes manières. La plus importante fait intervenir une séquence de transdésamination au cours de laquelle les "groupements NH2" sont transférés de l'acide aminé vers des composés receveurs pour aboutir soit à une désamination, essentiellement de glutamate mais aussi de sérine, avec production de NH4+ et de NH3 soit à la formation de composés transporteurs de groupements NH2; essentiellement la glutamine mais aussi le glutamate, l'alanine et la sérine (figure 6-8). Ce dernier mécanisme paraît généralement répandu à partir des tétrapodes. Comme nous le verrons par la suite (2.4 ci-après), l'ammoniac, vu sa toxicité n'est en général produit que par des espèces aquatiques ou ayant des accès aisés à l'eau. Pour les autres, vertébrés comme invertébrés, les groupements NH2 sont stockés sur des molécules moins toxiques, urée ou acide urique. Le devenir de ces groupements n'a été bien étudié jusqu'à présent que chez les vertébrés, pour lesquels nous résumerons brièvement la situation.
Figure 6-8: Catabolisme protéique et séquence de transdésamination aboutissant à la formation de NH4+ et de NH3 ou de métabolites transporteurs de "groupements NH2".
2.2.1. Formation d'urée
Chez les vertébrés terrestres et semi-terrestres, la séquence de
transdésamination a lieu dans tous les tissus et aboutit à la formation de
métabolites transporteurs qui, véhiculés dans le sang, aboutissent au foie
où leurs groupements NH2 vont être utilisés à la formation
d'urée. Dans ce processus, les groupements NH2 sont d'abord
libérés pour entrer dans un cycle aboutissant à la synthèse d'urée (figure 6-9). En fait, comme on le voit, le premier azote de
l'urée provient directement des métabolites transporteurs alors que le second
provient de l'aspartate, un acide aminé dicarboxylique pouvant être formé
dans tous les tissus mais aussi dans le foie par transamination de glutamate sur
de l'oxaloacétate. Le carbone de l'urée provient lui du CO2
libéré par le métabolisme oxydatif hépatique. Les squelettes hydrocarbonés
des métabolites transporteurs restants ne sont pas perdus mais utilisés à la
synthèse de glucose. Il est intéressant de remarquer ici que le foie est le
seul organe à pouvoir effectuer de manière significative cette
néoglucogenèse, jouant ainsi un rôle essentiel dans l'économie métabolique
générale. Le rôle du foie n'est en effet pas seulement de "détoxifier"
les groupements NH2 libérés mais aussi de retourner à l'organisme,
sous forme de glucose, l'essentiel des éléments carbonés utilisés dans ce
processus.
Figure 6-9: Utilisation des métabolites transporteurs de groupements NH2 à la synthèse d'urée et de glucose dans le foie. Les séquences métaboliques comprises entre les traits grisés sont strictement ou essentiellement mitochondriales alors que les autres sont cytosoliques. Il existe des systèmes de translocation faisant passer les métabolites d'un côté à l'autre de la membrane mitochondriale (cfr. physiologie cellulaire).
Une partie de la glutamine produite dans les tissus peut être désamidée en glutamate puis désaminée en a -cétoglutarate au niveau du rein. Elle fournit dans ce cadre l'ammoniac intervenant dans les échanges Na+/NH4+ rénaux et la balance acide/base du sang (cfr. physiologie cellulaire).
2.2.2. Formation d'acide urique
Chez différentes espèces, reptiles et oiseaux notamment, le produit
terminal majeur du métabolisme des groupements NH2 provenant des
protéines n'est pas l'urée mais l'acide urique (voir aussi 2.4
ci-après). Le système de synthèse n'est pas encore très clairement défini.
Il semble que ces animaux aient recours à une suite de réactions complexes
impliquées dans la synthèse du noyau purine (figure 6-10).
Ce noyau serait alors oxydé en acide urique dans la séquence de dégradation
des bases puriques (voir 2.3 ci-après).
Figure 6-10: Synthèse de l'acide urique : apport des métabolites transporteurs de groupements NH2. PRPP: 5 - Phosphoribosyl - 1 - Pyrophosphate.
De nombreux invertébrés terrestres synthétisent également de l'acide urique par un système que l'on suppose analogue; il reste cependant très mal étudié à l'heure actuelle.
Le ou les sites tissulaires de synthèse de l'acide urique sont par ailleurs inconnus. Chez les vertébrés, on a cru longtemps que cette synthèse était l'apanage du foie. Il semble cependant que les reins, les muscles ainsi que le cerveau et les tissus lymphoïdes possèdent l'arsenal enzymatique complet nécessaire à sa formation.
2.2.3. Autres voies
Il semble que la désamination des acides aminés provenant des protéines
puisse s'effectuer par deux autres voies que celle de la transdésamination
décrite ci-dessus (figure 6-8). Le premier système fut
proposé en 1971 par Lowenstein (Science 171, 397) et implique la
participation d'AMP et d'IMP, d'où son nom de cycle des nucléotides puriques (figure 6-11). Des études ultérieures ont montré que ce
système paraît limité chez les vertébrés à certains tissus des
mammifères, essentiellement aux muscles. Chez les invertébrés, il pourrait
intervenir au niveau de l'hépatopancréas des mollusques.
Figure 6-11: Le cycle des nucléotides puriques comme système de désamination des acides aminés provenant des protéines.
L'oxydation directe par une enzyme peu spécifique, l'oxydase des acides aminés, pourrait également contribuer à la désamination chez les invertébrés notamment.
Les bases puriques constituent, à côté des protéines, une autre source importante de groupements azotés. Elles peuvent être dégradées en une série de composés qui seront éliminés par excrétion. La séquence métabolique complète est chez les vertébrés essentiellement hépatique et va en fait des bases puriques, adénine et guanine, à l'ammoniac en passant par l'acide urique, l'allantoïne, l'acide allantoïque et l'urée (figure 6-12). Il est intéressant de remarquer ici que certaines enzymes de la séquence ont disparu avec l'évolution, arrêtant le catabolisme des bases puriques à certains niveaux chez certaines espèces. Ainsi, l'uréase semble avoir disparu à partir des poissons, avec la transition des vertébrés à une vie semi-terrestre. Ceci limite les amphibiens notamment à la production d'urée. L'allantoïcase, l'allantoïnase et l'uricase auraient disparu dans la transition allant des amphibiens aux reptiles et aux oiseaux ainsi qu'aux primates, limitant ces espèces à la production d'acide urique. Les autres mammifères ont eux conservé l'uricase et excrètent donc de l'allantoïne et de l'acide urique.
Figure 6-12: La dégradation des bases puriques chez les animaux.
Les formes majeures des produits terminaux du métabolisme azoté sont l'ammoniac, l'urée et l'acide urique. Il semble exister une relation très nette entre le produit majeur excrété par un organisme et la disponibilité de l'eau dans son environnement (tableau 6-1). On a ainsi classé les organismes en ammoniotéliques, uréotéliques et uricotéliques en fonction de la forme essentielle sous laquelle ils éliminent l'azote : ammoniac et sels ammoniacaux, urée, acide urique.
Tableau 6-1
Produits majeurs de l'excrétion azotée chez différentes espèces
| Animal | Composé azoté | Habitat | Environnement de l'embryon |
| Invertébrés aquatiques | ammoniac* | aquatique | aquatique |
| Poissons téléostéens | ammoniac* | aquatique | aquatique |
| Sélaciens | urée | aquatique | aquatique |
| Amphibiens têtard adulte |
ammoniac* urée |
aquatique semi-terrestre |
aquatique |
| Mammifères | urée | terrestre | aquatique |
| Reptiles tortues aquatiques crocodiles |
acide urique acide urique-urée acide urique-ammoniac* |
terrestre aquatique semi-terrestre |
œuf cléïdoique œuf cléïdoique œuf cléïdoique |
| Oiseaux | acides uriques | terrestre | œuf cléïdoique |
| Invertébrés terrestres (insectes, gastéropodes) |
acide urique | terrestre | œuf cléïdoique |
Comme nous l'avons signalé, l'ammoniac paraît relativement toxique et n'est utilisé comme produit d'excrétion des groupements azotés que chez des espèces aquatiques : invertébrés et poissons téléostéens. Cette élimination est effectuée par les reins mais aussi par les branchies, ce qui procure une surface d'échange importante et donc minimise les risques d'accumulation. Aux pHs physiologiques, plus de 9O % de l'ammoniac se trouve sous forme d'ions NH4+. Les mouvements de ces ions au niveau des surfaces d'échange rénales et branchiales paraissent essentiellement impliquer des transports d'échange Na+/NH4+ (cfr. Physiologie cellulaire). Certains résultats récents indiquent que les ions ammonium pourraient ainsi être excrétés contre un gradient de concentration; ce qui va à l'encontre des idées classiques selon lesquelles l'excrétion azotée sous forme ammoniacale est essentiellement diffusionnelle.
La production d'urée apparaît avec les sélaciens et certains poissons pulmonés où, comme nous l'avons vu, l'urée est essentiellement utilisée à des fins osmotiques. On la retrouve aussi, en plus petites quantités et on ne sait encore trop pourquoi, chez quelques téléostéens marins comme le poisson crapaud. L'urée devient un produit majeur d'excrétion azotée avec les amphibiens et donc avec l'accès à la vie terrestre et la limitation de la disponibilité de l'eau. Elle est conservée chez les mammifères. Chez certaines de ces espèces, le rapport entre produit d'excrétion azotée et disponibilité de l'eau est remarquablement marqué. Ainsi chez les batraciens, le têtard de grenouille aquatique est ammoniotélique alors que l'adulte, semi-terrestre est uréotélique. Chez certains poissons pulmonés, il existe une relation très nette entre la proportion d'urée et d'ammoniac formés et la disponibilité de l'eau dans l'environnement (figure 6-13). L'urée intervient par ailleurs directement dans les balances hydriques et osmotiques chez différentes espèces. C'est le cas chez les sélaciens (voir chapitre 1). On note également chez certains batraciens et poissons pulmonés comme le protoptère, une augmentation importante de la formation d'urée au cours de l'estivation. Ceci permet une augmentation considérable de l'osmolarité sanguine qui aide au maintien d'une hydratation correcte de ces espèces au cours de l'assèchement progressif des mares. L'accumulation d'urée permet encore à certains batraciens comme Xenopus laevis ou Rana cancrivora de pouvoir vivre en eau saumâtre. Elle leur permet en effet de maintenir un sang isosmotique au milieu extérieur et d'éviter ainsi des problèmes de balance hydrique.
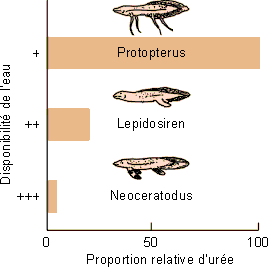 |
Figure 6-13: Production d'urée par rapport à celle d'ammoniac en fonction de la disponibilité de l'eau dans l'environnement de trois poissons pulmonés. |
Chez bon nombre d'espèces terrestres, c'est cependant l'acide urique qui devient le produit majeur de l'excrétion azotée. L'acide urique présente sur l'urée l'avantage de pouvoir être précipité sous forme de différents sels et dès lors de pouvoir être éliminé avec très peu d'eau, voire d'être stocké en attendant de pouvoir être éliminé. Cette propriété fait de l'acide urique un produit d'excrétion azotée de choix pour les animaux désertiques notamment, ayant très peu d'eau à leur disposition. Elle fait par ailleurs de l'acide urique le seul composé possible pour les animaux terrestres dont le développement embryonnaire s'effectue dans une coquille fermée n'ayant que peu d'échanges avec l'extérieur (œuf cléidoïque).