
Le cycle du fer joue un rôle important dans la respiration :
- au niveau tissulaire , par l’hémoglobine , qui assure le transport de l’oxygène moléculaire ,
- au niveau cellulaire , par les enzymes comportant du fer .
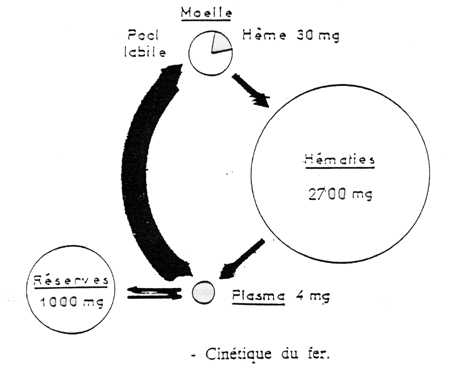
A - SCHEMA GENERAL DU CYCLE DU FER
1 - Les flux de fer sont ainsi schématisés par Najean :

2 - Répartition du fer dans l’organisme
(tableau n° 63)
Il faut noter que les flux entre compartiments ne sont pas proportionnels au volume de ces compartiments en raison des vitesses très différentes de leurs taux respectifs de renouvellement .
(1 sur le schéma général)
1 - se fait sous deux formes :
sans parler du fer thérapeutique éventuel ;
2 - le contenu en fer des aliments est très variable :
| mg / 100 mg | Mg / 1 000 Kcalories | |
| lait , beurre , fromages | 0,1 à 0,3 | 0,3 à 0,6 |
| carottes , choux , choux-fleurs , tomates | 0,5 à 0,6 | 15 à 25 |
| farine , pain , pois , haricots secs | 3,3 à 7 | 13 à 20 |
| fruits frais | 0,2 à 0,7 | 3,5 à 8 |
| chocolat | 3,1 | 5,4 |
| viandes | 2,3 à 3,2 | 6 à 25 |
| abats | 2,4 à 15 | 7 à 121 |
| huîtres | 6 | 10,.7 |
| oeufs | 2,5 | 5,4 |
| poisson | 1 à 2 | 7,5 à 18 |
| boudin | 18 | 56,3 |
(le nourrisson nourri de lait et céréales est très souvent carencé comme certains vieillards pour la même raison)
3 - La quantité de fer apporté par 1 000 kilocalories ingérées
est la même sous toutes les latitudes (4 à 12 mg par jour) ce qui veut dire que la carence martiale est parallèle à la malnutrition globale ; cependant besoins en fer et en calories ne sont pas toujours parallèles , du bûcheron suédois à l’enfant scolarisé ou la femme enceinte à faible activité physique !
4 - L’absorbabilité du fer
- est très variable selon les aliments dans lesquels il se trouve :
| fer non héminique | fer héminique | ||
| riz | 0 à 2 % | soja | 6 à 10 % |
| épinards | 1 à 2 % | charcuterie | 10 à 15 % |
| haricots | 2 à 3 % | poisson | 10 à 15 % |
| maïs | 3 à 4 % | foie | + de 20 % |
| laitue | 4 à 5 % | muscle | + de 20 % |
TAUX D’ABSORPTION DU FER ALIMENTAIRE
(pour 2 à 4mg de fer ingérés)
- Elle est meilleure pour le fer héminique à besoins et doses égaux que pour le fer non héminique qui rentre dans des aliments moins coûteux d’où les carences martiales plus fréquentes dans les les milieux sociaux plus défavorisés .
- Elle est modifiée par la cuisson qui l’améliore , la qualité des récipients , en fer ou non , la présence d’argile qui la freine (eau boueuse des rizières ou pica des géophages), la prise de thé à table qui la freine , l’alcool , le vin surtout , qui l’accroissent en étant par ailleurs riches en fer .
(2 sur le schéma général)
est réglée pour faire face aux besoins , car il n’y a pas de régulation de l’excrétion , mais cette régulation est mal connue .
1 - Le siège de l’absorption du fer
est essentiellement le duodénum et la partie haute de l’iléon , mais elle existe de moins en moins forte jusqu’au côlon ; certaines gastrectomies court-circuitent le duodénum et entraînent une mal-absorption .
2 - Influence des facteurs externes :
- L’acide chlorhydrique de l’estomac dissout les complexes alimentaires et favorise la formation de chélates avec le fer non héminique .
- Dans l’intestin , les sécrétions intestinales , biliaires , pancréatiques , libèrent le fer des protéines alimentaires et abaissent le pH pour permettre sa liaison à des chélates ; l’importance de la motricité intestinale est grande (mal-absorption des diarrhées sévères chroniques).
- Les habitudes alimentaires , par l’apport éventuel de chélateurs , accroissent l’absorption : bière d’Afrique du Sud à base de maïs et sorgho .
- La desferroxiamine B per os inhibe l’absorption , mais ne joue que sur le fer ionisé , d’où son faible intérêt thérapeutique .
3 - Influence des facteurs internes
Deux anémies microcytaires carentielles génétiques de la souris mk amènent à évoquer deux étapes pour l’absorption du fer :
a. La fixation est un processus de liaison à des récepteurs " transferrine-like " de la bordure en brosse des cellules muqueuses duodénales , lié aux besoins en fer , fixant le fer héminique tel quel , détachant de ses chélates le fer non héminique .
b. Le fer pénétrant dans les cellules muqueuses
- a trois destinées possibles :
- Dans la muqueuse intestinale , le fer héminique est libéré du cycle porphyrinique par la xanthine-oxydase ; la protéine de transfert intracellulaire est une transferrine , identique ou similaire à celle du plasma .
4 - Régulation physiologique de l’absorption du fer :
a. elle serait liée au rapport quantitatif entre les trois voies possibles , par l’intermédiaire de la saturation variable de la transferrine cellulaire intestinale , c’est le classique " bloc muqueux ".
b. Mais cette régulation n’est pas parfaite :
pas de régulation pour le fer ionisé (accident d’intoxication possible chez l’enfant), excès de fer apporté chez l’alcoolique , hyperabsorption des dysérythropoïèses chroniques (thalassémies , anémies sidéroblastiques), hémochromatose génétique .
5 - Moyens d’étude de l’absorption du fer
On n’utilise plus que les méthodes isotopiques :
a. Le radiofer
- est administré sous forme de 59Fe ferreux per os à jeun en dose traceuse , ou d’aliments marqués " in vivo " ce qui est très lourd , ou encore de repas marqué par " extrinsic tag " , repas additionné d’un peu de radiofer .
- Trois méthodes sont valables et précises :
la comparaison de la dose absorbée avec celle éliminée , la comparaison de l’incorporation " in vivo " dans les hématies de deux radiofers donnés l’un per os , l’autre par voie veineuse , ce qui est très long et coûteux , le comptage global dès après l’ingestion du repas marqué et après 8 jours (fin du transit intestinal) ce qui est lourd et coûteux aussi .
- Les comités d’éthique , vue la petite dose de radio-activité ingérée , acceptent leur utilisation même chez le jeune enfant ou la femme enceinte ou chez les volontaires sains .
- Trois objectifs sont en effet possibles :
b. Un test au radiocobalt puisque l’absorption du cobalt suit celle du fer , est possible en quelques heures , basé sur le recueil des urines pendant 6 heures après ingestion d’une dose traçante .
La déficience en fer est un problème de santé publique : concernant 20 à 30 % des sujets dans les pays pauvres et une frange de la population dans les pays industrialisés .
Le dépistage s’appuye essentiellement sur la mesure de la ferritinémie .
La " fortification " systématique de l’alimentation est réservée aux pays où la carence est habituelle et l’anémie fréquente en incorporant le fer à un aliment largement consommé , ne changeant pas de goût , si le prix n’en est pas trop accru etc .... (farine , riz , sucre , condiments , farines pour jeunes enfants).
E - TRANSPORT DU FER DANS LE PLASMA ET PROTEINES PORTEUSES DE FER
1 - La transferrine , ou sidérophiline est la forme exclusive de transport de fer dans le plasma .
a. C’est une glycoprotéine de 679 résidus d’acides aminés et 76 000 daltons de poids moléculaire qui possède 28 phénotypes permettant de définir 28 groupes sériques , qui peut fixer 2 atomes de fer ferrique ; on la dosait par sa capacité à fixer le fer , mais ce " fer sérique " a perdu beaucoup de son intérêt pratique car il varie du simple au double dans le nycthémère .
b. Sa synthèse est hépatique , surtout , avec un renouvellement de 15 % par jour , non modifiée par les besoins .
c. Seule cette transferrine peut délivrer le fer à la cellule rouge jeune (3 sur le schéma général):
l’a-transferrinémie congénitale est rapidement mortelle et le fer libre circulant après intoxication est toxique (risque de collapsus).
d. Seules certaines cellules peuvent fixer la molécule de transferrine porteuse de fer:
- ce sont : les cellules du placenta , les hépatocytes , mais surtout les cellules rouges jeunes :
4 fois plus pour l’érythroblaste basophile que pour le réticulocyte , mais ce n’est plus possible pour le globule rouge mûr .
- Ces cellules possèdent des récepteurs dont on connaît bien la biologie moléculaire ;
- la fixation dure 10 à 30 minutes avec fixation du complexe Fe-Tf au récepteur , internalisation , libération du fer dans la cellule , à bas pH , libération de la transferrine libre et reconstitution du récepteur .
- La richesse en récepteurs intervient :
ils sont un marqueur de différenciation de la lignée rouge et on les reconnaît par un anticorps monoclonal comme OKT-9 .
2 - La ferritine
- est une coque protéique comportant un coeur de fer de taille variable et comportant 24 sous-unités basiques et acides à répartition variable .
- Le fer ferreux s’y accumule , s’y oxyde , et peut en ressortir grâce à des flavines réduites . Au delà de 4 000 atomes de fer par molécule , on aboutit à l’hémosidérine , visible en coloration de Perls .
- La ferritine du plasma , sécrétée par l’hépatocyte , présente au taux de 12 à 300 ng / ml (ou µg/l) , ne transporte pas de fer , mais les variations de son taux sont parallèles à celles des réserves de fer de l’organisme entier , d’où le grand intérêt de son dosage .
3 - La lactoferrine
glycoprotéine voisine de la ferritine , est surtout présente dans le lait et sert à l’apport de fer au nourrisson .
F - UTILISATION DU FER PAR L’HEMOGLOBINOSYNTHESE
(4 sur le schéma général)
1 - Apport du fer aux érythroblastes
a. La traversée de la membrane suppose donc un récepteur capable de recevoir le fer détaché de la transferrine ; sa régulation n’est pas connue mais n’est absorbé que le fer utile à la biosynthèse et seulement par les érythroblastes jeunes .
b. Le passage de la membrane à la mitochondrie est très rapide (moins de 30 minutes) grâce à une protéine " transferrine-like " différente de celle plasmatique .
c. Les inducteurs comme l’érythropoïétine n’agissent pas directement sur le taux des récepteurs ou la vitesse de transfert , mais les augmentent indirectement par action directe sur l’hémoglobino-synthèse en induisant la transcription des mARN de chaînes globiniques .
2 - L’incorporation du fer à l’hème a lieu dans les mitochondries grâce à l’hème-synthétase ou ferro-chélatase; un " déficit " à ce niveau engendre l’accumulation de fer sous forme de ferritine , puis hémosidérine dans les érythroblastes les plus mûrs prenant le nom de " sidéroblastes " , pathologiques ici ; la toxicité locale du fer donne un avortement médullaire et son recyclage , associé aux transfusions, une hémochromatose ; normalement , il n’y a que peu de fer dans les érythroblastes : 10 % de sidéroblastes de type I à un ou deux petits grains de fer qui sont des érythroblastes très peu mûrs .
3 - Moyens d’étude
4 - Transfert aux autres organes
la fixation hépatique peut intéresser les hépatocytes et les cellules de Küppfer , la fixation placentaire , 300 mg par grossesse , se fait grâce à la présence de récepteurs sur les villosités placentaires contre un gradient de concentration .
G - LE FER DE L’HEMOGLOBINE CIRCULANTE
(5 sur le schéma général)
- représente 70 % du fer total de l’organisme (près de 3 grammes chez l’adulte);
- chaque gramme d’hémoglobine comporte 3,4 mg de fer et un litre de sang à peu près 500 mg : l’apport transfusionnel dans les hémolyses chroniques (sans perte de fer) comporte un risque d’hémochromatose , les hémorragies , digestives et génitales , engendrent une déperdition de fer ;

(schéma n° 63)
- la ferrimétrie permet un dosage très précis de l’hémoglobine en solution ;
- le fer hémoglobinique est bivalent Fe++ , son oxydation en Fe+++ (mét-hémoglobinisation) rend l’hémoglobine impropre au transport de l’oxygène ; il a du fait de sa structure électronique périphérique
4 liaisons de coordination avec les 4 noyaux pyrrole de l’hème ,
2 liaisons de coordination avec des histidines globiniques sises en F8 et E7 et la fixation réversible d’oxygène en E7 maintient l’état ferreux dans les conditions normales .
H - PERTES (et besoins) EN FER EXOGENE
(5 bis sur le schéma général)
1 - Pertes communes aux deux sexes (très faibles normalement)
a. Pertes fécales (0,4 à 0,5 mg / jour chez l’adulte)
b. Pertes urinaires (0,1 mg / jour chez l’adulte)
on peut accroître cette élimination par la desferroxiamine B intraveineuse qui chélate le fer .
c. Pertes cutanées (1 à 5 µg / jour)
d. Don du sang trop fréquent , surtout si le sang est payé !
2 - Pertes propres à la femme
a. La menstruation élimine 40 à 50 ml de sang par cycle , soit 20 à 25 mg de fer (davantage sous stérilet , moins sous contraception orale), ce qui fait 0,8 mg de fer / jour sur l’ensemble du cycle , mais parfois plus de 1 mg chez 10 % des femmes considérées comme normales .
Les apports seront donc à multiplier par 2 ou 4 par rapport à l’homme .
Les hémorragies gynécologiques sont la cause la plus fréquente des anémies hypochromes ferriprives de la femme en période d’activité génitale , car si la menstruation dépasse 80 ml , les réserves risquent de s’épuiser .
b. La grossesse
Il y a perte supplémentaire de fer :
Par contre , l’arrêt des règles compense en faible part ce déficit .
Globalement , les besoins en fer augmentent progressivement pendant la grossesse jusqu’à 4 mg / jour , comme aussi le coéfficient d’absorption du fer , et faute d’apport complémentaire , il y aura épuisement des réserves de fer .
Les anémies de la grossesse , le plus souvent ferriprives , surtout dans nos contrées , sont liées à des grossesses répétées chez les sujets à la limite de la carence (émigrées) et certains préconisent une supplémentation systématique ; le retentissement sur l’enfant est nul tant sur le plan obstétrical que sur le plan martial .
3 - La croissance correspond à une augmentation des besoins pour accroître le capital martial et ceci va requérir un supplément de 0,5 mg / jour .
Le foetus a récupéré le fer maternel en fin de grossesse pour le stocker dans son foie , mais le prématuré est plus exposé aux carences ; le fer de la polyglobulie néonatale est récupéré .
Les besoins sont importants à deux moments : dans le second semestre de la vie et à la puberté , périodes où sont fréquentes les anémies hypochromes , surtout si le régime est mal équilibré et certains préconisent là aussi une supplémentation systématique (céréales avec fer incorporé).

(schéma n° 64)
4 - La recherche d’un excès de pertes de fer
- repose en pratique
sur un interrogatoire détaillé : pertes digestives , hémorroïdes , règles (durée , consommation de garnitures) , autres hémorragies comme des épistaxis , don du sang ..... et un examen clinique soigneux ,
- car le marquage des hématies in vitro , au 59Fe , suivi de la mesure de la radio-activité corporelle totale ou dans les excreta , est une méthode très précise , mais inapplicable en routine .
5 - La thérapeutique martiale
a. doit toujours reposer sur le fer oral :
sels ferreux , fonction de la tolérance gastrique (glutamate , fumarate ...), avec des additifs facilitant l’absorption (manitol) et de l’acide ascorbique , alors que la vitamine B 12 n’apporte qu’un surcoût inutile ; il faut savoir que le fer oral colore les selles !
b. Le fer parentéral intramusculaire , longtemps interdit en France , n’a que d’exceptionnelles indications .
c. Des accidents toxiques aigus sont possibles chez l’enfant après prise accidentelle d’une dose majeure.
I - MECANISMES DE REUTILISATION DU FER
(6 sur le schéma général)
1 - L’érythrophagocytose des hématies vieillies par les macrophages , médullaires essentiellement , est suivie d’une libération du fer dans ces macrophages , sans élimination , ni stockage à long terme , en physiologie ; dans les anémies hémolytiques , il en va de même avec une destruction splénique ou hépato-splénique .
2 - Le fer libéré est pour plus de 50 % recyclé en quelques heures à travers la transferrine plasmatique qui le ramène aux érythroblastes médullaires ; le reste est incorporé aux réserves à renouvellement lent , c’est à dire en ferritine .
En pathologie , le recyclage est rapide en cas de carence , mais en cas de lourd excès , la ferritine est transformée en hémosidérine .
3 - Les moyens d’étude de la réutilisation nécessitant un double marquage de la transferrine et de globules rouges lésés , sont très complexes .
4 - Deux troubles existent à ce niveau :
- la captation du fer dans les réserves lentement réutilisables , lors des infections sévères chroniques , maladies inflammatoires graves maladies malignes , réversible lors de la cure si elle est possible de la maladie en cause , ou sous simple traitement anti-inflammatoire , est source d’anémies hypochromes hyposidérémiques non ferriprives , très fréquentes , à fer sérique bas , mais à ferritinémie élevée .
- Les hémorragies viscérales intratumorales et l’hémosidérose pulmonaire idiopathique .
(7 sur le schéma général)
1 - Données physiologiques :
- le fer arrive du plasma , et parfois de l’apport alimentaire , de la destruction des hématies dans les macrophages , surtout .
- Il est restitué à la transferrine plasmatique pour être livré aux érythroblastes , après réduction par la ferriductase et les flavines réduites .
- Le stockage est surtout hépatique (plus du tiers): cellules de Küppfer , mais aussi hépatocytes , plus accessoire est le stockage splénique et médullaire (un tiers) ou musculaire (un tiers) .
2 - Données biochimiques : la forme de stockage est la ferritine .
- Les ferritines hépato-spléniques formes de réserve , se différencient de celles placentaires , musculaires , tumorales , par le pourcentage élevé de subunités L basiques .
- La synthèse d’apoferritine , protéine non chargée de fer , est le fait surtout des hépatocytes , induite par la quantité de fer du milieu.
- Plus elle est chargée en fer ferrique , ce qui peut porter son poids moléculaire de 480 000 daltons environ à près de 900 000 , moins elle est soluble et apte à rendre son fer ; à la limite se forme l’hémosidérine , totalement insoluble , inapte à rendre le fer , véritable corps étranger à l’organisme .
3 - Données morphologiques :
a. la ferritine est visible en microscopie électronique , d’aspect polygonal ;
b. L’hémosidérine sorte de polymère de ferritine englobant des lipides , glucides , protéines , est le " pigment ocre " des histologistes , colorable au Perls , en grains visibles en microscopie optique .
4 - L’évaluation des réserves martiales
- fait classiquement appel au Perls sur biopsies hépatiques ou sur ponction et biopsie médullaire en ne tenant compte que du fer des macrophages ;
- la ferritinémie , bien que la ferritine plasmatique n’ait aucun rôle dans le transport du fer , est un excellent reflet des réserves martiales, et elle est devenue facile à doser par immuno-enzymologie .
- Le test au DesféralR est un test dynamique permettant de présumer d’une efficacité thérapeutique .
5 - La limitation des surcharges martiales consiste à diminuer les apports et surtout à augmenter les pertes dans les hémochromatoses par des saignées ou par des chélateurs en cas d’hémopathies diverses exigeant des transfusions répétées .

(schéma n° 65)
1 - La myoglobine a une teneur en fer identique à l’hémoglobine , 2 à 3 mg de fer par gramme de muscle , d’où l’intérêt dans l’apport alimentaire de la viande qui contient aussi du sang .
2 - Le fer enzymatique peu abondant , mais essentiel aux métabolismes , est soit dans un groupement héminique (catalases) soit non héminique dans les flavoprotéines .
Tout ceci montre bien l’importance du fer en hématologie :
tout bilan d’une anémie hypochrome doit comporter son exploration , non plus par le dosage du fer sérique , dépassé , mais par celui de la ferritinémie , avant que les cartes ne soient brouillées par une thérapeutique martiale intempestive , trop fréquement observée , voire associée à d’autres produits inutiles (B 1 , B 6 , B 12 etc....) .
| Commentaires et Questions |