LA MORT DES GLOBULES ROUGES , OU HEMOLYSE
A - HEMOLYSE NORMALE ET PATHOLOGIQUE
- L’hémolyse représente la destruction des hématies sénescentes arrivées au terme de leur survie de 120 jours environ dans le sang circulant et dont la conséquence est la libération de l’hémoglobine qu’elles contiennent .
- Cette définition n’est donc pas étymologique : leucocytes , plaquettes , voire plasma ne sont pas concernés .
- On dit souvent " hémolyse " pour dire en fait " hémolyse excessive " , par abus de langage .
- Ce processus physiologique fonctionne normalement " a minima " :
il ne peut être réduit , il est équilibré par une production équivalente de globules rouges par l’hématopoïèse en cas d’hyperhémolyse , cette dernière est très plastique : suffisament pour maintenir une masse érythrocytaire correcte et l’on parle d’" hémolyse compensée " ou non , et l’on parle d’ " hémolyse décompensée " ou d’ " anémie hémolytique ".
B - LA DUREE DE (SUR)-VIE DES HEMATIES " IN VIVO "
peut s’étudier par 3 types de méthodes :
1 - Le calcul indirect de la lyse , à partir de la production , qui doit égaler la lyse , utilise le radiofer , traceur de l’hémoglobinopoïèse , et nécessite de connaître le volume globulaire total du sujet .
On peut ainsi tenir compte éventuellement d’une durée de vie très courte (hémolyse précoce) ou d’une érythropoïèse inefficace par avortement médullaire . On couple souvent cette épreuve avec celle au radiochrome pour réaliser un " fer-chrome ".
2 - Le marquage d’une cohorte de cellules d’âge donné
- utilise la 75séléno-méthionine , facile à compter , ou la glycine au 14C ou 15N , donnant des courbes plus proches de la courbe théorique .

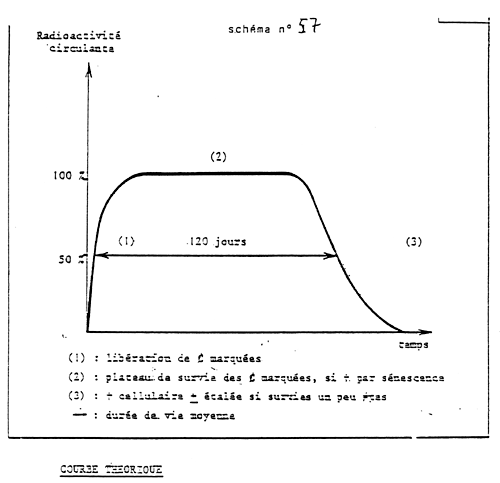
(schéma n° 57)
- On affirme ainsi que : la mort des globules rouges se fait par sénescence à cause de la présence du plateau (2) et non au hasard (on aurait à la place du plateau une pente continue) et que la durée de vie moyenne est de 120 jours .
Cette méthode ne fait pas partie de la pratique clinique courante .
3 - Le marquage au hasard n’utilise plus la méthode immunologique à partir d’hématies non-isogroupes compatibles , mais le marquage isotopique (sauf chez la femme enceinte) en pratique clinique .
Si le di-iso-propyl fluoro-phosphate (DF32P) permet un calcul de durée de vie réelle , le chrome 51 est bien plus largement utilisé .
- Le chromate 51Cr O4 Na2 se fixe sur l’hémoglobine de globules rouges prélevés , marqués , puis , réinjectés ;
- le 51Cr s’élue sans se refixer après hémolyse ;
- la décroissance de l’isotope n’entre pas en ligne de compte car on mesure la radioactivité en même temps pour tous les échantillons collectés de 2 en 2 jours ;
- la chute de 50 % de la radio-activité injectée , le T1/2 , est de 30 +/- 4 jours normalement , mais peut tomber à 10 , voire 3 jours en cas d’hémolyse sévère .

(schéma n° 58)
- La méthode est utilisable en autoglobules , pour mettre en évidence la simple réalité d’une hémolyse excessive , ou isoglobules , signant une hémolyse extra-corpusculaire si le T1/2 reste diminué , une hémolyse intra-corpusculaire si le T1/2 est alors normalisé . On n’injecte jamais de sang d’un malade à un sujet sain pour des raisons éthiques (en France) .
- Les comptages externes révèlent le siège de la destruction des globules rouges : rate ou foie , et sont d’un apport précieux pour discuter de l’efficacité possible d’une splénectomie - On peut aussi apprécier une hémorragie concommittante , digestive ou génitale , en recherchant la radio-activité dans les selles ou les garnitures périodiques .
C - LA RAISON DE LA SENESCENCE DES HEMATIES
cause de leur mort , nous disent les courbes de survie ,
sera reconnue en comparant hématies jeunes et âgées .
1 - On les sépare plus ou moins facilement par centrifugation différentielle , par hémolyse osmotique fractionnée , en couplant éventuellement les deux méthodes et en contrôlant l’âge des globules rouges après radio-marquage et prélèvements échelonnés .
2 - Les hématies âgées subissent - des modifications importantes :
de forme : sphération ,
- On retiendra surtout la baisse de nombreuses activités enzymatiques , prévisible dans des cellules anucléées qui vieillissent , notamment , apo- et co-enzymes qui ne peuvent être renouvelées ni régénérées dans leur forme réduite active par un cercle vicieux irréversible .
- Le déficit de la glycolyse anaérobie entraîne sans doute un déficit en ATP avec perte de la déformabilité membranaire conduisant au trappage dans le système macrophagique et une chute concommittante de NADH avec mét-hémoglobinisation , mais ce n’est pas un facteur de destruction globulaire .
- Le déficit du shunt des pentoses va priver l’hématie de NADPH , donc diminuer le glutathion réduit , facteur de protection contre la méthémoglobinisation, surtout la dénaturation des protéines et enzymes à groupe thiols ou la production de peroxydes , puissants agents hémolytiques .
3 - Des facteurs extra-globulaires sont aussi évoqués :
- la fixation sur la membrane de substances lytiques savons , sels biliaires , lyso-lécithines , carbo-hydrases , importante surtout en pathologie (auto- et iso-anticorps , agressions médicamenteuses , micro-organiques , physiques); la fixation aspécifique d’immunoglobulines entraînant la phagocytose par les macrophages passe maintenant pour être le facteur principal de la mort des globules rouges ;
- l’érythrostase , dans les sinusoïdes , surtout spléniques , zones à bas pH , pauvres en glucose , cholestérol et surtout oxygène , agresse par contre les globules âgés peu déformables , donc stagnant davantage et dont l’affinité pour l’oxygène accroît encore l’anoxie locale , d’où autre cercle vicieux !
D - LE SIEGE DE L’HEMOLYSE PHYSIOLOGIQUE
1 - est le macrophage .
Les images d’érythrophagocytose sont certes rares en microscopie optique chez le sujet normal , mais les stigmates du phénomène ont été bien vus en microscopie électronique .
Les globules rouges âgés , sans doute parce que leur forme et la composition de leur membrane sont modifiées , adhèrent au macrophage , puis , sont captés dans une vacuole et digérés hors des vaisseaux ; en cas de fragmentation cytoplasmique préalable (hémolyse intravasculaire) , peu importante en physiologie , il y a phagocytose des seuls stromas .
2 - Macroscopiquement ,
- plus de 50 % des globules rouges normaux sont , chez l’homme , détruits dans le système macrophagique de la moelle osseuse .
- Le rôle des cellules de Küppfer du foie est faible normalement .
- La rate a un rôle physiologique faible sur les globules rouges normaux (la splénectomie ne modifie pas leur durée de vie); son rôle est important pour éliminer les globules rouges à contenu anormal , voire ce seul contenu , lors d’un premier passage , puis , le globule fragilisé est détruit : grains de fer , corps de Heinz , restes de noyau comme les corps de Jolly , vacuoles autophagiques , tous éléments qui sont présents dans les globules rouges après splénectomie , avec une grande fréquence .
En pathologie , son rôle est parfois très important .
E - CATABOLISME DE L’HEMOGLOBINE
Parmi les composants du globule rouge , seule la destinée de l’hémoglobine et de ses catabolites est un problème spécifique ; problème important , car chaque jour , 6,25 à 7,5 grammes d’hémoglobine sont détruits , conduisant à une excrétion biliaire de 250 à 300 mg de bilirubine .
1 - Dans la cellule macrophage , l’hémoglobine restée intacte durant la vie du globule rouge ,
a. est dégradée

(schéma n°59)
dans une formation vésiculaire différente de celle lysosomiale où sont digérées les membranes , et schématiquement , l’hème-alpha-méthènyl-oxygénase de Tenhunen détache un CO d’un pont méthène pour donner un complexe globine-Fe+++-biliverdine , à 4 noyaux pyrrole , mais non cyclique ; le fer et la globine s’en séparent ensuite et la biliverdine-réductase réduit la biliverdine en bilirubine en présence de NADH .
b. Le fer , soit 21 mg / jour , accumulé sur place sous forme de ferritine ou d’hémosidérine colorable par le Perls , sera utilisé pour les synthèses (sauf en cas d’infection ou inflammation chronique où il est " bloqué ").
c. La globine est disséquée en 16 acides aminés différents , repris dans le pool général des acides aminés avec ceux émanant du stroma avant d’être réutilisés pour les synthèses protéiques , mais ceci consomme beaucoup de calories .
d. La bilirubine , seul véritable déchet , mais dont l’élimination dépense peu de calories ,
- est excrétée dans le plasma , sous une forme très peu soluble dans l’eau , liée à l’albumine de façon étroite , ce qui interdit le passage rénal ; elle est dite " libre " ou " non conjuguée " ou " indirecte " car elle n’est pas décelée directement par la réaction de Hyjmans Van Den Berg (HVDB indirecte); son taux normal est inférieur à 20 mg / l , mais s’il dépasse 1 500 à 2 000 , il y a atteinte toxique du système nerveux central (ictère nucléaire), dans les hémolyses graves .
- Sa captation est élective par l’hépatocyte qui réalise la glycuro-conjugaison de la bilirubine grâce à une UDP-bilirubine-glycuronyl-transférase , dont la synthèse est stimulée par le phénobarbital (traitement symptômatique des ictères); cette bilirubine conjuguée est hydrosoluble , donc éliminable par la bile , ou par le rein si elle passe dans le plasma lors des ictères par rétention ; elle est révèlée par la réaction directe de Van Den Berg (HVDB directe) et elle est normalement absente du sang , sauf ictère par rétention .
- Remarque :

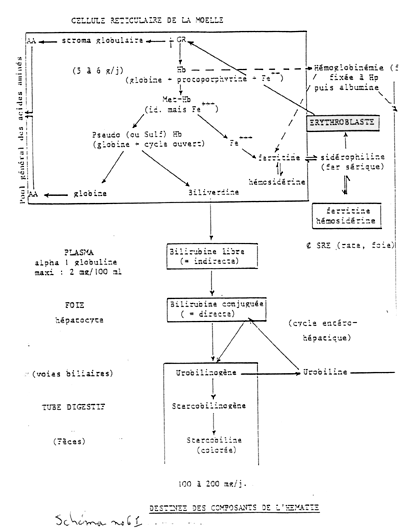
(schémas n° 60 et 61)
- Le mécanisme de l’excrétion biliaire est mal connu .
- Dans la lumière intestinale , la bilirubine est transformée en urobilinogènes dont 20 % sont oxydés en urobiline et résorbés dans le sang pour être ré-éliminés par les urines (urobilinurie de 4 mg / 24 heures) ou les voies biliaires (cycle entéro-hépatique); les 80 % restant vont se transformer en sterco-bilinogènes , oxydables en stercobiline jaune orangé qui colore les matières fécales , d’où les selles " mastic " des ictères par rétention " a contrario ".
2 - L’hémoglobine libérée dans le plasma par hémolyse intravasculaire , normalement très faible ,
a. est liée à l’haptoglobine en un complexe stable et soluble , mais non filtrable par le glomérule rénal , qui sera phagocyté par le système macrophagique , surtout hépatique , pour que l’hémoglobine soit catabolisée en bilirubine .
b. Quand l’haptoglobine est débordée , l’hémoglobine libre gagne pour moitié le système macrophagique du foie , comme ci-dessus

(2a sur le schéma n° 62)
mais peut aussi franchir le glomérule rénal : elle sera résorbée par le tubule proximal et catabolisée (2b1) en bilirubine par le rein , qui élabore les enzymes nécessaires ; le fer est stocké sous forme d’hémosidérine qui desquame plus tard (hémosidérinurie qui va permettre un diagnostic rétrospectif d’hémolyse intravasculaire); quand le tubule est dépassé apparaît une hémoglobinurie (2b2) qui peut se compliquer d’anurie dans les cas sévères .
c. Une faible partie de l’hémoglobine plasmatique est rapidement transformée en mét-hémoglobine qui perd son hème à Fe+++ donnant l’hématine que fixent : l’hémopexine , rapidement éliminée par l’hépatocyte et la bile (3a) et une albumine , ce qui forme la mét-hémalbumine , sorte de réserve plasmatique de l’hématine , car éliminable seulement après retour de l’hème sur l’hémopexine (3b)
3 - L’hémoglobine des corps de Heinz conduit à une pigmenturie , c’est à dire une élimination de dipyrroles dans des urines noires .
F - LIENS ENTRE HEMOLYSE ET ERYTHROPOIESE
Ils assurent un volume globulaire total constant .
Ils sont mal connus mais peut-être directs : en cas d’hémolyse compensée , on observe une réticulocytose sanguine et une érythroblastose médullaire .
Si l’érythropoïèse peut palier les excès de l’hémolyse , l’inverse n’est pas vrai car cette dernière ne peut être réduite . Il faut d’ailleurs en tenir compte pour comprendre le mécanisme d’une anémie normochrome ou d’une polyglobulie .
G - TABLEAUX CLINICO-BIOLOGIQUES D’UNE HEMOLYSE EXCESSIVE
1 - Hémolyse aiguë intravasculaire
Elle correspond à un excès d’hémoglobine plasmatique , par exemple , après transfusion incompatible .
a. Clinique : fièvre , frissons (les cellules détruites libèrent des pyrogènes), pâleur livide , choc : hypotension artérielle , tachycardie , oligo-anurie (parfois nécessité d’épuration), douleurs abdominales , vomissements , diarrhée , lombalgies , urines rouges (bon signe sous anesthésie générale).
b. Signes cytologiques : anémie normochrome , en principe normocytaire , parfois sévère (tableau suraigu), mais parfois présence de signes qui forment le tableau de fond chronique sur qui se greffe l’épisode aigu , peut-être brutal .
c. Signes biochimiques : élévation de l’hémoglobine plasmatique , normalement inférieure à 10 mg / l , pouvant atteindre 100 mg (le plasma est alors coloré en rouge); puis , successivement , en fonction de la gravité , baisse , voire disparition de l’haptoglobine libre , baisse de l’hémopexine et présence de mét-hémalbumine , élévation de la lactico-déshydrogénase (LDH), hémoglobinurie , à bien différencier d’une hématurie ou d’une myoglobinurie , bien plus tard , hémosidérinurie , excellent signe de diagnostic rétrospectif .
N.B. On ne recherche pas les signes isotopiques face à un tableau aigu , voire suraigu !
2 - Hémolyse chronique
a. Clinique : signes d’anémie , seulement en cas d’hémolyse décompensée , progressive (bien supportée), ictère peu foncé (anémie associée) , avec selles hypercolorées et urines orangées , sans bradycardie , ni prurit (signes d’ictère par rétention), splénomégalie modérée , variable d’un jour à l’autre , signes de complications évolutives : lithiase biliaire pigmentaire , signes cutanés moins fréquents , à type d’ulcères de jambe , hémochromatose rare , signes osseux (hyperplasie de la moelle) cliniquement patents ou visibles à la radio .
b. Signes cytologiques : anémie normochrome normocytaire , sauf en cas d’anomalie corpusculaire causale , réticulocytose , présence d’hématies polychromatophiles et parfois d’érythroblastes dans le sang , érythroblastose médullaire , pouvant atteindre 80 % dans une moelle riche mais moins intéressante à rechercher qu’une réticulocytose sanguine traduisant comme elle la... " régénération ": on parle d’ " anémie régénérative ".
c. Signes biochimiques :
- certains traduisent un hypercatabolisme de l’hémoglobine : hyperbilirubinémie libre (ou indirecte à l’HVDB), l’un des meilleurs signes d’hémolyse , mais qui peut manquer par exemple si le foie s’adapte à conjuguer davantage , hyperurobilinurie ;
- l’élévation du fer sérique traduit plus directement l’hémolyse ;
- d’autres signes traduisent le rajeunissement de la population érythrocytaire :
d. Les signes isotopiques sont intéressants dans les cas difficiles à débrouiller , mais la méthode est coûteuse et astreignante pour le malade (cf supra).
N. B. : la distinction entre hémolyse aiguë intravasculaire et hémolyse chronique extravasculaire est plus didactique que tout à fait réelle !
3 - Le tableau d’ictère néo-natal est tout à fait particulier . avec une clinique très variable , un contexte familial important à bien connaître , des signes biologiques visant soit à établir le diagnostic positif : anémie , hyperbilirubinémie , tout en étant précieux pour décider d’une transfusion ou une exsanguino-transfusion , soit au diagnostic étiologique : test de Coombs direct , car on oppose les ictères néo-nataux à Coombs + et à Coombs - .
H - ETUDE DE L’HEMOLYSE IN VITRO
Elle dispose de moyens très divers dont le choix est orienté par le tableau clinico-biologique : ethnie du sujet , tableau aigu ou chronique par exemple , mais la pratique du " bilan d’hémolyse " à l’aveugle est à proscrire formellement pour des raisons économiques ; beaucoup de ces signes visent à poser le diagnostic étiologique .
1 - Moyens cytologiques
a. étude de la morphologie érythrocytaire : directement sur lame standard : sphéro- , drépano- , schizo-cytes ? parfois après action de réducteurs (tests de Beutler ou test de falciformation), ou en utilisant des colorations spéciales (corps de Heinz ?);
b. mesure du taux des réticulocytes sanguins en valeur absolue , plus utile que l’étude de la moelle sauf cas particuliers .
2 - Etude de l’auto-hémolyse (tests de Dacie)
partant du sang défibriné laissé 24 ou 48 heures à 37° C . Normalement , moins de 5 % de l’hémoglobine est libérée dans le sérum , mais en cas de défaut métabolique , on dépasse franchement les 5 % . On peut essayer une correction par l’ATP (déficit en pyruvate-kinase) ou faire des tests en présence de glucose .
3 - Test de résistance globulaire :
osmotique en présence de diverses dilutions de ClNa , mécanique en présence de billes de verre calibrées , acide (test de Ham-Crosby).
4 - Dosages biochimiques :
a. dans les urines :
hémoglobine et dipyrroles , plus tard hémosidérine , dans les hémolyses aiguës intravasculaires ; urobiline dans les hémolyses chroniques
b. dans le sang :
hémoglobine plasmatique et haptoglobine libre dans les hémolyses intravasculaires , HVDB indirecte , hémoglobine glycosylée , créatinine globulaire dans les hémolyses chroniques , étude de l’hémoglobine : Singer , Kleihauer , électrophorèse , chromato-graphie , solubilité à l’état réduit , dosage de la stabilité du glutathion réduit , dosages enzymatiques : G6PD , pyruvate-kinase etc...
5 - Etudes immunologiques :
recherche d’anticorps anti-globules rouges , en particulier par le test de Coombs direct , auto- ou iso-anticorps dont on détermine : les caractères thermiques d’activité , la nature chimique IgG , IgM ou mixte , les rapports avec le complément ou un allergène .
J - CLASSIFICATIONS DES ANEMIES HEMOLYTIQUES
1 - Anémies hémolytiques corpusculaires qui sont en général congénitales ou mieux " héréditaires ".
a. Classification physiopathologique : membrano-pathies : sphéro- ou ellipto-cytoses congénitales , érythro-enzymo-pathies : déficits en G6PD , pyruvate-kinase etc...
hémoglobino-pathies : hémoglobinoses (qualitatives) : avec hémoglobine anormale S , C , E , M , instable , syndromes thalassémiques (quantitatifs) avec répartition anormale d’hémoglobines normales , porphyrie érythropoïétique .
b. Classification pratique :
dans la race blanche (parfois néo-natal): sphéro-cytose héréditaire , déficit en pyruvate-kinase ;
dans la race noire : drépano-cytose (HbS) et associations (SC et S-Thalassémie), HbC , si chronique , G6PD , si accident aigu médicamenteux ,
chez les Méditerranéens et orientaux : thalassémie (alpha et bêta), HbE , si chronique , G6PD , si accident aigu médicamenteux ou néo-natal (ou alpha -thalassémie).
2 - Anémies hémolytiques extra-corpusculaires qui sont en général acquises :
- liées à une agression directe : toxines microbiennes ou virales , parasites (paludisme), agent physique : brûlure , prothèse cardiaque , marche , anomalie des capillaires (dont ceux des métastases), CIVD , agent chimique (métaux lourds , champignons), toxines cancéreuses ;
- liées à des anticorps , le plus souvent chez nous (allo- ou auto-anticorps , d’origine médicamenteuse);
- hémoglobinurie paroxystique nocturne .
Elle cherche à limiter l’hémolyse " in vitro " :
- en freinant le métabolisme du globule rouge
- en remplaçant les substances consommées : glucose du CPD ;
- en pratique , en France , on conserve le plus souvent 35 jours à + 4° C en CPD (acide citrique , citrate , phosphate , dextrose) et l’on congèle les groupes rares ou le sang destiné à l’auto-transfusion .
| Commentaires et Questions |