4.1.1. Modification du volume d'éjection
a. facteurs intrinsèques
b. facteurs extrinsèques4.1.2. Modifications de la fréquence cardiaque
a. contrôle par centres supérieurs
b. contrôle par voie réflexe
1. Les efférences
2. Les récepteurs
c. autres influences
4.2.1. Régulations locales (autorégulation)
4.2.2. Régulations hormonales
4.2.3. Régulations nerveuses
4.3.1. Régulation à l'effort
a. modification du débit cardiaque
b. modification de répartition du flot sanguin4.3.2. Régulation suite à hémorragie
4.3.3. Régulation suite à des effets gravitationnels
Ce contrôle s'exerce en fait à deux niveaux: 1) celui de l'activité cardiaque, par lequel le débit cardiaque va pouvoir être modifié considérablement, 2) celui des résistances périphériques, par lequel, en jouant sur le diamètre des artères et artérioles essentiellement, la répartition du flot sanguin au niveau des organes va pouvoir être modifiée.
Le contrôle du débit cardiaque est un élément essentiel de la régulation de l'irrigation tissulaire. On le retrouve de façon plus ou moins évoluée, chez toutes les espèces possédant un système circulatoire organisé.
Comme nous l'avons déjà signalé (2.2.1.), le débit cardiaque est une mesure de la quantité de sang éjectée par le cœur par unité de temps. Il correspond au produit de la fréquence cardiaque par le volume d'éjection systolique. Chez un homme au repos ayant par exemple une fréquence cardiaque de 75 battements/min. et un volume d'éjection de 77 ml, le débit cardiaque est de 5,775 l/min. (tableau 2-1).
Une modification de débit peut donc être obtenue par variation de fréquence cardiaque et/ou de volume d'éjection. Les deux paramètres ne varient pas de la même façon chez toutes les espèces pour une même sollicitation.
Au cours de l'exercice, par exemple, il y a une augmentation importante du débit cardiaque. Chez la truite, il passe de 17,4 ml/min à 52,9 ml/min lorsque l'animal passe du repos à une nage à vitesse moyenne. La fréquence passe dans ces conditions de 37,8 à 51 (x 1,4) et le volume d'éjection de 0,46 ml à 1,03 ml (x 2,25). Le même type de mesure chez le pigeon au repos ou en vol donne Qc: 195 ml/min à 1065 ml/min (x 5,5), F: 115 P/min à 670 P/min (x 5,8) et Ve: 1,70 ml à 1,59 ml (x 0,9). Chez l'homme en passant du repos à un exercice d'intensité moyenne Qc passe de: 5250 ml/min à 15000 ml/min (x 2,85) avec F: 75 P/min à 150 P/min (x 2) et Ve: 70 ml à 100 ml (x 1,43). Chez l'homme comme chez la truite, l'augmentation de débit cardiaque est donc obtenue par modification à la fois du volume d'éjection et de la fréquence cardiaque. Chez le pigeon par contre, il y a uniquement modification de fréquence.
4.1.1. Modification du volume d'éjection
Les variations de volume d'éjection sont obtenues par modification de la puissance de
contraction du muscle cardiaque. On parlera parfois d'effets inotropes pour désigner les
variations de puissance de contraction. Ces variations peuvent faire intervenir des
processus de régulations différents: intrinsèques ou extrinsèques.
a. facteurs intrinsèques
On envisage essentiellement ici un mécanisme autonome de modification de la puissance de
contraction qui est en rapport avec une propriété des fibres contractiles. En fait, une
fibre musculaire étirée, du moins dans une certaine limite (voir contraction
musculaire), va se contracter plus fortement que lorsqu'elle est stimulée à sa
longueur de repos. Dans ce cadre, la puissance de contraction et donc, dans une certaine
mesure, le volume d'éjection vont dépendre de la pression de remplissage diastolique
(figure 2-24). Le volume de sang entrant dans le ventricule influe en
effet directement sur le volume de la cavité et donc sur la longueur des fibres
musculaires. Ce type d'effet est important notamment au cours de l'exercice dans lequel la
mobilisation des masses musculaires augmente le retour veineux et donc la pression de
remplissage (voir plus loin). Il a été mis en évidence chez différents invertébrés
et chez la plupart des vertébrés, des poissons aux mammifères, bien que son rôle
physiologique ait été mis en doute chez ces derniers dans les années 70.
b. facteurs extrinsèques
Sont essentiellement envisagés ici la stimulation par voie nerveuse sympathique
(figure 2-24) et par les catécholamines déversées dans le sang à
partir de la médullo-surrénale (stress par exemple; voir plus loin: hormones). Les
effets les plus importants sont de loin ceux obtenus par voie sympathique. L'effet
inotrope positif est ici dû à une entrée de Ca2+ dans les fibres musculaires
cardiaques (voir physiologie cellulaire).
4.1.2. Modifications de la fréquence cardiaque
Ces modifications sont essentiellement associées à des variations de la fréquence de
génération des influx au niveau du tissu nodal ou rythmeur. On parlera dans ce cas
d'effets chronotropes. Ces effets sont sous dépendance nerveuse et hormonale
(catécholamines - stress). Ils ont été mis en évidence chez tous les vertébrés. Un
contrôle nerveux de la fréquence cardiaque semble aussi généralement répandu chez les
invertébrés. Ce type de contrôle n'a cependant été bien étudié que chez les
vertébrés et surtout chez les mammifères.
Chez les vertébrés, le contrôle nerveux de la fréquence cardiaque implique un centre cardio-vasculaire bulbaire qui intègre des informations venant soit des centres nerveux supérieurs, soit, dans un système réflexe, de récepteurs périphériques.
a. contrôle par centres supérieurs
Il est nettement moins important que le contrôle par voie réflexe (voir
b. ci-dessous). Par exemple, l'émotion suffit à modifier la fréquence cardiaque.
Une certaine excitation s'accompagnera généralement d'une augmentation de fréquence
(tachycardie) alors qu'un choc émotionnel intense a souvent un effet inverse
(bradycardisant). Ces effets, qui peuvent être associés aux effets tachycardisants que
le stress exerce par voie hormonale, paraissent impliquer les lobes frontaux et des fibres
les reliant à l'hypothalamus et au noyau dorsal du vague (voir plus loin: système
nerveux).
b. contrôle par voie réflexe
Ce système de contrôle met en jeu les informations transmises de récepteurs
périphériques. Celles-ci sont intégrées au niveau d'un centre cardio-vasculaire
bulbaire qui envoie au cœur des efférences excitatrices et inhibitrices
(figure 2-25).
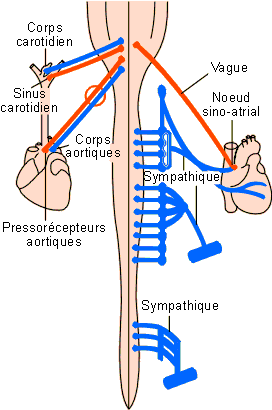 |
Figure 2-25: Contrôle du débit cardiaque et du diamètre artériolaire. Les éléments sensoriels sont à gauche, les éléments efférents à droite. |
1. Les efférences
Les efférences excitatrices sont des fibres sympathiques provenant chez les
mammifères des ganglions cervicaux et thoraciques. Les transmetteurs synaptiques sont des
catécholamines (noradrénaline, cfr. physiologie cellulaire).
Les efférences inhibitrices sont des fibres du nerf vague (pneumogastrique -X). La transmission synaptique est ici cholinergique, impliquant l'acétylcholine (récepteurs muscariniques, cfr. physiologie cellulaire).
Remarquons ici que les fibres sympathiques qui ont un effet chronotrope positif ont également un effet inotrope positif (voir 4.1.1.). Une stimulation de ce système engendrera donc à la fois une augmentation de la fréquence cardiaque et du volume d'éjection. Il n'en va pas de même pour les fibres vagales qui n'ont qu'un effet chronotrope négatif et pas d'effet inotrope.
Ces effets sont essentiellement les mêmes chez tous les vertébrés, des sélaciens aux mammifères. Les influences vagales paraissent toutefois plus marquées chez les pœcilothermes tandis que le contrôle sympathique parait dominant chez les homéothermes (oiseaux et mammifères). Chez les agnathes, la situation est un peu différente. Le cœur de lamproie par exemple ne reçoit qu'une innervation vagale excitatrice (acétylcholine, récepteurs nicotiniques, voir physiologie cellulaire) alors que le cœur de myxine ne parait pas recevoir d'innervation extrinsèque et est insensible à l'acétylcholine comme à la noradrénaline. Certains téléostéens comme les pleuronectidés n'ont, comme la lamproie, pas d'innervation sympathique. Par ailleurs, chez de nombreux poissons ainsi que chez les amphibiens anoures, les fibres sympathiques se trouvent mêlées aux fibres vagues. Les urodèles par contre possèdent comme les oiseaux et les mammifères des innervations vagales et sympathiques distinctes.
L'inhibition vagale peut être particulièrement puissante en hypoxie chez les pœcilothermes ou chez certains homéothermes lors de l'hibernation (voir écophysiologie) ou de la plongée (voir chapitre 3, section 4).
2. Les récepteurs
Les récepteurs impliqués dans les contrôles réflexes de la fréquence cardiaque
sont sensibles soit aux variations de tension de la paroi des vaisseaux (barorécepteurs),
soit au pH, à la teneur en CO2 ou en O2 (chémorécepteurs).
Chez les mammifères, on trouve des barorécepteurs 1) dans l'arbre artériel systémique: au niveau de la crosse aortique, au départ des sous-clavières gauche et droite ainsi que dans les artères carotides externes, au niveau du sinus carotidien et de la jonction thyrocarotidienne; 2) au niveau du tronc de l'artère pulmonaire et dans ses branches de division gauche et droite; 3) dans les ventricules. Ces récepteurs vont être essentiellement impliqués dans une régulation en rétroaction de la pression artérielle (voir plus loin). On trouve également des pressorécepteurs à l'union des veines caves et pulmonaires avec les oreillettes. Ces récepteurs seront impliqués dans l'augmentation de fréquence qu'induit une augmentation brusque du volume auriculaire (réflexe de Bainbridge). Ce type de réflexe a été mis en évidence chez les vertébrés et différents invertébrés (figure 2-26).
 |
Figure 2-26: Effet de la pression de perfusion sur la fréquence cardiaque au niveau du cœur isolé d'un malacostracé. |
On trouvera des chémorécepteurs au niveau: 1) des noyaux du centre cardio-vasculaire bulbaire, 2) des carotides, 3) de la crosse aortique.
L'essentiel des régulations induites va s'effectuer par voie vagale (inhibitrice) et sympathique (excitatrice). Schématiquement, une stimulation des barorécepteurs (tension augmentée) ou des chémorécepteurs (CO2 diminué ou pH augmenté) va provoquer une augmentation des influx sur les voies afférentes allant au centre bulbaire. Il en résultera une augmentation des influx vagues et une diminution des influx sympathiques et donc une diminution de la fréquence cardiaque (figure 2-27). Inversement, une hypotension ou une augmentation de PCO2 sanguine va induire une diminution des influx des barorécepteurs ou des chémorécepteurs. Il en résultera une diminution des influx vagues, une augmentation des influx sympathiques et une augmentation de la fréquence cardiaque (figure 2-27).
Figure 2-27: Influx nerveux intervenant dans la régulation de la fréquence cardiaque et des résistances périphériques suite à une variation de pression artérielle.
c. autres influences
D'autres facteurs que ceux discutés ci-dessus influencent la fréquence cardiaque. Parmi
ceux-ci, retenons la température: la fièvre à des effets chronotropes positifs alors
que l'hypothermie a des effets chronotropes négatifs. Ces effets paraissent la plupart du
temps accompagnés d'un effet inotropes allant en sens contraire: fièvre: inotrope
négatif - hypothermie: inotrope positif.
Le contrôle des résistances vasculaires est d'importance. Il va en effet permettre de diriger le flot sanguin sélectivement, de façon à opérer la meilleure répartition possible (exercice, plongée etc...). Il faut par ailleurs remarquer qu'une perfusion maximale de tous les organes à la fois dépasserait les possibilités du cœur. Chez les homéothermes, le contrôle du flot sanguin au niveau de différentes régions intervient d'autre part de façon essentielle dans la régulation thermique (cfr. écophysiologie).
La régulation de la circulation s'effectue essentiellement au niveau des artérioles, par modification du tonus de fibres musculaires lisses. On distingue classiquement des régulations locales, humorales et nerveuses.
4.2.1. Régulations locales (autorégulation)
Une variation de pression artérielle va, de façon tout à fait passive, influer sur le
diamètre des vaisseaux. Ainsi une diminution de pression peut provoquer le collapsus de
certains vaisseaux, par "écrasement" au sein des masses tissulaires.
Inversement, une augmentation de pression provoquera une vasodilatation. C'est un
phénomène que l'on observera par exemple dans le recrutement des capillaires au niveau
des muscles squelettiques pendant l'exercice (voir plus loin). Au niveau de certains
tissus, rein et cerveau notamment, on remarque des effets dits myogènes qui viennent
contrebalancer les effets vasodilatateurs. Dans ces cas, l'augmentation de diamètre
induit une contraction de la musculature vasculaire. Ces effets myogènes permettent de
régulariser la perfusion au niveau des organes où ils existent alors que la pression
artérielle est augmentée pour satisfaire d'autres besoins (exercice par exemple:
voir 4.3.1. ci-après).
Une carence en oxygène provoque de façon directe une vasodilatation au niveau de l'essentiel des tissus. Cet effet s'ajoute à celui obtenu via le contrôle nerveux (voir 4.2.3. ci-après). Curieusement, une chute de teneur en O2 provoque une diminution de perfusion au niveau pulmonaire. Cet effet reste mal expliqué. Il en résulte en tout cas que le flot sanguin est dirigé vers les zones du poumon riches en oxygène.
L'augmentation de concentration en certains métabolites en relation avec l'activité énergétique (CO2, ADP, AMP) provoque également une vasodilatation. Cet effet s'ajoute à celui de la carence en oxygène et peut ainsi rendre compte de l'hyperémie réactionnelle observée au niveau d'un membre suite à un blocage de l'irrigation (garrot par exemple).
4.2.2. Régulations hormonales
Elles seront discutées au chapitre concernant les hormones. Signalons simplement ici que
les catécholamines ont des effets périphériques vasoconstricteurs (intervention dans le
stress). L'angiotensine, une hormone intervenant dans le contrôle de la volémie et de la
natriémie sanguine, est également vasoconstrictrice. L'histamine par contre est
vasodilatatrice. Ces substances peuvent avoir des effets strictement locaux (histamine) ou
relativement larges lorsqu'elles sont déversées dans le flot sanguin (adrénaline).
4.2.3. Régulations nerveuses
Elles font essentiellement intervenir le sympathique via le centre cardio-vasculaire
bulbaire.
Le contrôle sympathique du diamètre des vaisseaux n'est pas encore complètement éclairci. Chez les mammifères, on admet comme idée de base que les terminaisons sympathiques (adrénergiques) agissent sur des récepteurs vasculaires de deux types : a et b. Les a sont vasoconstricteurs et les b vasodilatateurs. Au niveau des reins et de la peau, seule une vasoconstriction parait possible. La vasodilatation dans ces cas est passive et due à des effets locaux d'augmentation de pression artérielle rendus possibles lorsque les influx sympathiques vasoconstricteurs diminuent et permettent une diminution du tonus musculaire. Au niveau des autres tissus (muscle squelettique, muscle cardiaque notamment), la présence de récepteurs b permet une vasodilatation active par diminution du tonus musculaire. Cette vasodilatation b adrénergique parait très limitée ou absente chez les poissons, les amphibiens et les reptiles.
Le parasympathique (cholinergique) n'intervient que dans un petit nombre de cas: vasodilatation au niveau des glandes salivaires ou des organes génitaux externes chez les mammifères, vasoconstriction pulmonaire chez les amphibiens et les reptiles, vasoconstriction branchiale chez les poissons.
Les récepteurs d'information n'ont été que très peu étudiés chez les espèces autres que mammaliennes. Chez les mammifères, ces récepteurs sont ceux intervenant dans le contrôle de l'activité cardiaque: barorécepteurs et chémorécepteurs. Dans ce cadre, une diminution de pression artérielle provoquera une augmentation d'influx vasoconstricteurs et donc une augmentation de résistance périphérique (réflexe barostatique:figure 2-27). Il en va de même pour une augmentation en CO2, une diminution en O2 ou une acidification.
Un réflexe barostatique a été mis en évidence chez tous les vertébrés de même que chez différents invertébrés. Dans de nombreux cas les barorécepteurs associés restent à mettre en évidence. Il semble que chez les vertébrés inférieurs le système de chémorécepteurs est nettement moins efficace. Chez eux, les facteurs chimiques pourraient intervenir de façon essentiellement locale alors qu'ils interviendraient de façon à la fois locale et nerveuse chez les mammifères. Les effets locaux sont de toute façon loin d'être négligeables chez les mammifères. Chez eux, la perfusion du cerveau ou du muscle cardiaque par exemple parait en effet dépendre assez largement de facteurs locaux. La perfusion de la peau dépend par contre essentiellement d'un contrôle nerveux qui peut être réflexe, mais aussi central (thermorégulation, émotions).
Un point particulier concerne le flot sanguin aux organes respiratoires chez les animaux aquatiques utilisant un système pulmoné de façon intermittente (voir chapitre 3, 3.3). Certains poissons et amphibiens respirent en effet principalement via des systèmes aquatiques (branchie, peau) mais peuvent faire appel de façon intermittente à un système respiratoire additionnel de type "pulmoné". La plupart de ces espèces possèdent des systèmes de contrôle par vasoconstriction au niveau branchial ou cutané permettant un certain ajustement du flot sanguin entre la circulation systémique et les circulations respiratoires principale ou annexe. Protopterus possède ainsi des sites de vasoconstriction particuliers permettant de contrôler le débit sanguin indépendamment au niveau des organes respiratoires additionnels (figure 2-28). Chez les anoures, le contrôle implique une vasoconstriction cholinergique vagale de l'artère pulmocutanée et une vasoconstriction adrénergique sympathique de la circulation cutanée. Un contrôle spécifique de la vasoconstriction sur la partie du circuit cutané lié à la circulation systémique permet de contrôler la circulation respiratoire en plongée indépendamment du reste de la circulation cutanée. Le système pulmonaire et son contrôle disparaît chez les amphibiens apodes et chez certains urodèles à respiration essentiellement cutanée comme Cryptobranchus, chez Necturus à respiration essentiellement branchiale ainsi que chez les urodèles pléthodontidés devenus secondairement apneumones.
 |
Figure 2-28: Circulation respiratoire et sites majeurs de contrôle (*) chez des espèces aquatiques pratiquant une respiration bimodale. A: Hoplerythrinus sp. un poisson sans contrôle particulier de la respiration aérienne d'appoint. B: Protopterus sp. un poisson pulmoné. C: Xenopus sp. un amphibien. A: atrium; AG: atrium gauche; AD: atrium droit; V: ventricule; BRA, CUT, ORA, PULM, SYS: circulation branchiale, cutanée, dans l'organe respiratoire d'appoint, pulmonaire, systémique. |
Envisageons maintenant quelques exemples de contrôle du flot sanguin. Les régulations intervenant à l'effort (activité physique, exercice), lors d'une perte de sang importante ou lors d'un changement de position représentent des cas typiques d'adaptation du système cardio-vasculaire à différentes sollicitations: variation en O2 et CO2 dans le premier cas, variation de volume sanguin dans le second et variation de pression veineuse dans le troisième.
4.3.1. Régulation à l'effort
Le travail (l'effort) musculaire fait partie des activités normales des animaux. Au plan
physiologique, l'effort ne doit donc pas être considéré comme un événement
irrégulier et temporaire mais plutôt comme une activité normale, même essentielle de
la vie des animaux. Dans ce cadre, les mécanismes de contrôle du système
cardio-vasculaire qui ont évolués chez eux sont particulièrement bien adaptés aux
modifications des besoins énergétiques que requière l'augmentation d'activité
physique.
Quantifier la relation travail-demande énergétique et évaluer de façon comparée les adaptations cardio-vasculaires à un effort donné reste souvent très difficile. Les mesures de base devraient être établies, pour le travail, à partir de l'énergie fournie dans un système impliquant des mouvements simples et répétitifs (roue à activité, bicyclette ergométrique, tapis roulant, tunnel de vol ou de nage, etc...). C'est loin d'être toujours le cas. En général donc, les variations des paramètres cardio-vasculaires sont rapportées à l'augmentation de consommation d'oxygène apparaissant à l'effort plutôt qu'à l'intensité du travail effectué. La consommation d'oxygène est en effet de mesure simple et directement en relation avec la demande énergétique des organismes (cfr. chapitre 3). Elle est dans ce cadre toujours proportionnelle à l'importance du travail effectué (tableau 2-5). Un examen comparatif des données établies sur de telles bases reste cependant difficile puisque le rendement au travail de l'effort musculaire fourni est éminemment variable en fonction non seulement de l'animal mais aussi du type de travail effectué.
TABLEAU 2-5
Relation entre travail fourni et consommation d'oxygène chez l'homme
| Travail | kgm/min | Repos | 300 | 600 | 900 | 1200 | 1800 |
| W | 50 | 100 | 150 | 200 | 300 | ||
| QO2 | l/min | 0,3 | 0,9 | 1,5 | 2,1 | 2,8 | 4,1 |
Pour satisfaire à l'augmentation du besoin en oxygène lié à l'accroissement d'activité, deux modifications fonctionnelles essentielles vont apparaître: une modification du débit cardiaque et une modification de répartition du flot sanguin, favorisant l'irrigation des masses musculaires mises au travail. Le tableau 2-6 résume les modifications de différents paramètres observées chez un sujet sportif soumis à un exercice à des intensités croissantes.
a. modification du débit cardiaque
Le travail musculaire induit immédiatement: 1) une diminution de teneur en O2
du sang ainsi qu'une augmentation de teneur en CO2. 2) Une augmentation du
retour veineux au cœur par activation des pompes veineuses.
Ces variations vont induire une augmentation du débit sanguin. L'augmentation de la pression de remplissage va en effet augmenter la puissance de contraction alors que les variations en O2, CO2 et pH vont augmenter la fréquence cardiaque par voie nerveuse. La stimulation sympathique renforcera par ailleurs l'augmentation de la puissance de contraction.
Le débit total sera donc augmenté, cette augmentation était proportionnelle à l'effort fourni (tableau 2-6). La répartition du flot sanguin va également être modifiée, les débits aux différents organes variant considérablement.
b. modification de répartition du flot sanguin
Celle-ci est opérée par modification du diamètre des vaisseaux. Cette modification est
due: 1) A une stimulation sympathique induite par les variations des paramètres chimiques
du sang (pH, CO2, O2). Dans ce cadre, on notera une vasodilatation
au niveau des muscles cardiaques et squelettiques ainsi qu'une vasoconstriction au niveau
cutané et splanchnique. L'irrigation cérébrale n'est pas significativement affectée
(tableau 2-6). 2) Aux variations en métabolites (O2, CO2,
AMP, ADP...) qui, au niveau local (muscles squelettiques), vont induire une
vasodilatation. 3) A l'augmentation de pression artérielle résultant de l'augmentation
de débit cardiaque et de la vasoconstriction touchant une partie du réseau. Cette
augmentation de pression va provoquer l'ouverture des capillaires normalement collabés au
niveau des muscles squelettiques (phénomène de recrutement).
L'ensemble de ces modifications fait que la quantité de sang irriguant les muscles passe de 20 à 25 % du volume total en conditions de repos à quelque 70 - 75 % lors d'un effort important.
Comme le montrent les résultats du tableau 2-6, les variations induites sont progressives, adaptées au niveau de l'effort fourni et donc de la demande énergétique croissante. Lorsque l'effort est excessif par rapport aux possibilités de réaction du système cardio-vasculaire, les besoins du muscle ne sont pas compensés. L'apport en oxygène devient alors trop faible et le muscle travaille en anaérobie, avec production d'acide lactique. Le muscle établit dans ces conditions une dette d'oxygène (cfr. chapitre 3) et des crampes peuvent alors survenir, empêchant l’activité, si la situation perdure.
TABLEAU 2-6
Variation des différents paramètres cardio-vasculaires chez un sujet sportif
en fonction de l'intensité de l'effort fourni
| Travail (W) | 0 | 100 | 200 | 300 |
| Débit systémique | 5 | 9 | 17 | 25 |
| Débit cérébral | 0,8 | 0,8 | 0,8 | 0,8 |
| Débit myocarde | 0,25 | 0,35 | 0,75 | 1 |
| Débit muscles | 1 | 5 | 12 | 22 |
| Débit rein | 1,1 | 0,8 | 0,6 | 0,4 |
| Fréquence cardiaque | 70 | 100 | 140 | 190 |
| Pression artérielle | 120/70 | 140/80 | 170/90 | 200/90 |
| Saturation veineuse | 75 | 65 | 50 | 40 |
Les mécanismes décrits ci-dessus paraissent présents chez tous les vertébrés, avec les quelques variantes que nous avons déjà signalées en envisageant spécifiquement le contrôle nerveux des systèmes cardiaques et vasculaires. Les études détaillées manquent chez les invertébrés. Il paraît toutefois clair que le travail musculaire induit ici également une augmentation de la fréquence cardiaque et du débit sanguin.
4.3.2. Régulation suite à hémorragie
La diminution de la masse sanguine consécutive à une hémorragie déclenche un ensemble
de réactions au niveau cardio-vasculaire dont le but est de préserver l'apport en
oxygène au niveau du cœur et du cerveau, organes essentiels sensibles à l'hypoxie.
Comme le montre la figure 2-29, la perte de sang affecte tout d'abord le réservoir veineux. La pression veineuse diminue alors ainsi que le retour vers le cœur, ce qui entraîne une diminution du volume de remplissage et du débit systémique. Dans la phase initiale dite de compensation, la pression artérielle ne varie pas significativement par suite des effets compensateurs: augmentation de la fréquence cardiaque et augmentation de résistance périphérique et splanchnique intervenant dans le cadre du réflexe barorégulateur. La vasoconstriction ainsi engendrée entraîne une diminution de l'irrigation de la peau et des viscères. L'irrigation cérébrale, beaucoup plus dépendante des conditions locales et de la pression artérielle, est par contre maintenue (figure 2-29). L'hémorragie est ainsi compensée tant que la perte de sang ne dépasse pas, chez l'homme, 600 ml. Pour des pertes plus importantes, les mécanismes décrits, bien que continuant à fonctionner, sont insuffisants: il y a alors décompensation. La pression artérielle ainsi que l'irrigation cérébrale et cardiaque ne peuvent être maintenues malgré l'augmentation de la tachycardie et de la résistance périphérique. Au-delà d'une perte de 1 litre de sang, la baisse d'irrigation cérébrale entraîne un mauvais fonctionnement des centres de contrôle de la circulation; les effets régulateurs tendent à disparaître entraînant le collapsus. Les risques d'anoxie et de lésions irréversibles dépendent de la durée de celui-ci.
4.3.3. Régulation suite à des effets gravitationnels
Ce problème a été essentiellement étudié chez l'homme qui peut présenter
des vertiges passagers mais parfois des troubles plus graves lors du passage de la
position horizontale à la position verticale. Les régulations mises en œuvre
paraissent significatives des régulations qui doivent intervenir chez les vertébrés
terrestres de grande taille pouvant être sujet à des effets d'orthostatisme. Chez un
sujet en position horizontale, la pression hydrostatique est sensiblement la même dans
tout le système veineux. Lors du passage à la position verticale, l'effet gravitationnel
provoque une accumulation de sang dans les veines des membres inférieurs avec
augmentation de pression et distension des parois. Cette accumulation locale agit un peu
à la manière d'une hémorragie; elle provoque une diminution du retour veineux au
cœur. Dans le même temps, les veines supérieures ont tendance à se collaber par
diminution de pression (effet gravitationnel + diminution de retour veineux). La
diminution du retour veineux entraîne une diminution du volume systolique et du débit
cardiaque ainsi qu'une chute de pression artérielle. Normalement cette situation n'est
que passagère, la compensation se faisant rapidement par l'augmentation réflexe de la
fréquence cardiaque et du tonus vasculaire qu'induit la baisse de pression.
L'effet d'orthostatisme est accentué si le sujet est mis en position verticale de façon passive (lit, table basculante); dans ce cas en effet, les pompes veineuses ne sont pas sollicitées ce qui augmente la stase veineuse au niveau des membres inférieurs. Dans certains cas (mauvais tonus veineux, veines dilatées), le stockage sanguin est tel qu'il provoque une chute de tension importante et persistante qui peut se poursuivre jusqu'à la syncope. L'effet est ici comparable à celui d'une hémorragie dépassant les possibilités de compensation. En cas d'hypotension orthostatique aboutissant à la syncope, la chute remet le sujet en position horizontale ce qui le ramène aux conditions d'équilibre initial.
La station debout immobile prolongée, particulièrement par temps chaud peut à la longue provoquer le même genre de troubles. On peut estimer chez l'homme l'augmentation de stockage dans les membres inférieurs à quelque 200 à 300 ml en conditions normales. Elle peut atteindre 600 à 800 ml en cas de troubles de la tonicité veineuse (figure 2-30). La chaleur accroît le stockage alors que le froid le réduit.
 |
Figure 2-30: Evolution du volume de sang accumulé par orthostatisme dans les membres inférieurs chez l'homme. |