2.2.1. La pituitaire ou complexe neuro-adénohypophysaire
a. morphologie, évolution, présentation générale
b. hormones de l'adénohypophyse
c. hormones de la neurohypophyse
d. contrôle des productions du complexe neuro-adénohypophysaire2.2.2. La thyroïde
a. production et rôle des hormones
b. synthèse des hormones thyroïdiennes
c. contrôle de production des iodothyronines2.2.3. Les parathyroïdes
2.2.4. Îlots endocrines du pancréas
2.2.5. Les surrénales
2.2.6. Les gonades
2.2.7. Autres glandesa. la glande pinéale et le complexe épiphysaire
b. le thymus
c. le tube digestif
d. le cur et le facteur atrial natriurétique
2.3.1. Régulation hormonale de la calcémie sanguine
2.3.2. Régulation hormonale de la volémie et de la natriémiec. le système rénine - angiotensine
d. le facteur natriurétique auriculaire
e. autres hormones2.3.3. Régulation hormonale de la glycémie
a. insuline et glucagon
b. contrôle de sécrétion
c. effets de l'insuline et du glucagon
d. déficience en insuline2.3.4. Réactions hormonales aux stress
2.3.5. Régulation hormonale de la croissancea. sécrétion et effets de la GH
b. effets synergiques d'autres hormones
c. mues et métamorphoses2.3.6. Contrôle hormonal de la gamétogenèse
1) Phase préovulatoire
2) Ovulation
3) Phase postovulatoire
4) Effets des hormones produitesb. gamétogenèse testiculaire
c. aspects comparés
2.4.1. Croissance, mues et métamorphoses
2.4.2. Iono et osmorégulation
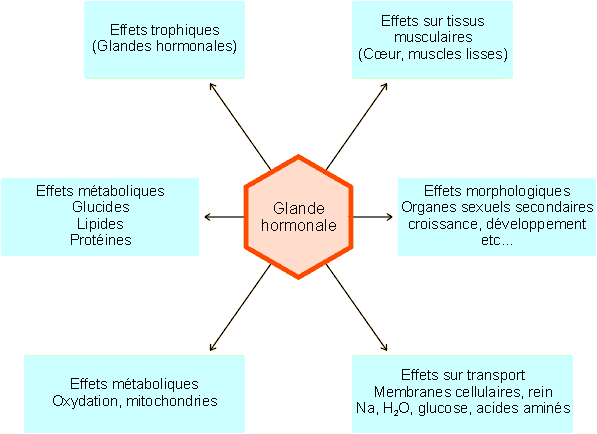
Comme nous l'avons déjà signalé, les hormones sont des sémiomolécules sécrétées par des groupes de cellules caractéristiques. Déversées dans le sang, elles atteignent leurs cellules - cibles après un trajet plus ou moins long dans le système circulatoire. Les hormones agissent généralement à très basse concentration (10-10 - 10-7 M) et produisent des effets extrêmement spécifiques soit sur tous les types cellulaires soit sur certains tissus ou organes. On distinguera ainsi des hormones à action ubiquitaire et des hormones à action restreinte. Les hormones agissant sur tous ou sur de nombreux types cellulaires ont en général des effets métaboliques : régulation du métabolisme du glucose, des lipides et/ou des protéines, régulation du métabolisme oxydatif (par exemple : hormones de croissance, thyroïdienne, insuline, etc. ). Les autres hormones n'agissent en général que sur un ou quelques tissus particuliers ; elles peuvent avoir des effets trophiques (induisant la sécrétion d'autres hormones), des effets morphologiques, des effets sur le tonus des muscles lisses ou cardiaque ou sur des mécanismes de transport (figure 9-2).
Figure 9-2 : Types d'effets hormonaux.
La plupart des hormones sont de nature polypeptidiques ou protéiques. Certaines d'entre elles, comme les hormones sexuelles, les hormones du cortex surrénalien des vertébrés ou les hormones de mue des arthropodes, sont des stéroïdes dérivés du noyau squalène. Quelques hormones enfin ne font pas partie de ces deux grandes catégories. Ainsi, les hormones à effets métaboliques de la thyroïde des vertébrés sont des dérivés iodés de la tyrosine et de la tyronine alors que l'hormone juvénile des insectes est, elle, de type terpénique (figure 9-3).
Figure 9-3 : Nature chimique des hormones à travers quelques exemples.
Les hormones paraissent toutes agir par l'intermédiaire de l'association avec un récepteur spécifique de la cellule - cible. Les récepteurs sont soit membranaires pour les hormones ne pouvant passer la membrane plasmique (hormones peptidiques, protéiques, adrénaline de la médullaire surrénalienne) soit cytoplasmiques pour les hormones liposolubles pouvant accéder aisément par diffusion au milieu intracellulaire (hormones stéroïdes et thyroïdiennes iodées). Les problèmes relatifs à la réception et à la signalisation intracellulaire des messages hormonaux seront envisagés en détail plus loin (cfr. sections 4 et 5).
Les hormones ont été beaucoup plus étudiées chez les vertébrés que chez les invertébrés. Il n'existe en fait pour ces derniers que quelques études pouvant à l'heure actuelle être intégrées dans des ensembles cohérents concernant essentiellement la croissance et la mue. Nous nous concentrerons donc essentiellement sur les glandes endocrines et sur quelques exemples de régulations hormonales chez les vertébrés.
Les vertébrés possèdent une dizaine de structures pouvant être considérées comme glandes endocrines. Certaines d'entre elles sont homologues chez les différentes espèces et produisent des hormones souvent de structures chimiques identiques ou très proches et ayant des effets similaires sur les mêmes systèmes - cibles (figure 9-4). L'homologie est cependant loin d'être de règle. Ainsi les parathyroïdes n'existent pas chez les poissons et il n'y a pas de cellules a dans les îlots endocrines pancréatiques des urodèles. De même, certains tissus qui pourraient avoir des activités de type hormonales chez les poissons comme les corpuscules stannieux ou l'urophyse sont absents dans les autres groupes.
Figure 9-4 : Evolution du système hormonal chez les vertébrés. Il existe de très nombreuses homologies entre le système endocrinien de l'homme et d'un poisson téléostéen. Il existerait chez les poissons un système supplémentaire, celui de l'urophyse, quoique son rôle comme glande hormonale reste peu clair. Détails dans le texte.
La présentation des glandes hormonales sera dès lors axée sur le système endocrinien des mammifères en ne considérant pour les différentes glandes que les aspects comparés les plus marquants. Nous renvoyons le lecteur intéressé par une étude comparative plus détaillée à l'excellent ouvrage de Norris "Vertebrate endocrinology".
2.2.1. La pituitaire ou complexe
neuro-adénohypophysaire
a. morphologie, évolution, présentation générale
La glande pituitaire est présente dans le cerveau de tous les vertébrés, des
poissons aux mammifères. Elle peut être considérée comme l'une des glandes
endocrines les plus importantes par le nombre d'hormones qu'elle secrète et
dès lors par la variété des activités biologiques qu'elle contrôle.
Elle est constituée de deux parties morphologiquement et embryologiquement distinctes. La neurohypophyse, d'une part, qui, comme son nom l'indique, est d'origine nerveuse et dérive embryologiquement du plancher du diencéphale (thalamus, hypothalamus). L'adénohypophyse, d'autre part, qui est dérivée d'une évagination de la voûte palatine et qui vient se fixer, lors du développement embryonnaire, à l'avant de la neurohypophyse. Dans ce cadre, l'adénohypophyse est parfois appelée lobe antérieur de l'hypophyse, la neurohypophyse devenant le lobe postérieur ou posthypophyse. L'hypophyse reste reliée à l'hypothalamus dans le cerveau par la tige pituitaire, l'ensemble étant souvent considéré comme un tout fonctionnel : le complexe hypothalamo-hypophysaire (figure 9-5). La neurohypophyse reçoit ainsi les prolongements des cellules neurosecrétrices de différents noyaux hypothalamiques. L'adénohypophyse par contre se prolonge vers l'hypothalamus en un système porte-hypophysaire. Celui-ci assure le transport des productions hypothalamiques et donc le contrôle par le cerveau des productions hormonales du lobe antérieur( voir d ci-après).
La paroi postérieure de l'ébauche buccale, accolée à la neurohypophyse, subit un développement souvent très modéré. Elle va constituer un lobe intermédiaire entre la partie avant de l'adénohypophyse et la neurohypophyse. On distinguera ainsi dans l'adénohypophyse une pars intermedia d'une autre, plus importante qui la jouxte, la pars distalis. Dans ce contexte, la neurohypophyse deviendra la pars nervosa de l'hypophyse.
La pars intermedia est bien développée chez les poissons, les amphibiens et les reptiles ; elle est absente chez les oiseaux et très rudimentaire chez l'homme où elle disparaît pratiquement à la puberté par incorporation de ses cellules dans le lobe antérieur. La lumière de l'invagination buccale embryonnaire (poche de Rathke) subsiste entre les pars distalis et intermedia sous la forme d'une cavité étroite, la fente hypophysaire, bien visible chez les rongeurs, pratiquement inexistante chez l'homme (figure 9-5). L'adénohypophyse comporte encore une partie morphologiquement distincte des deux autres, la pars tubelaris, se localisant vers le haut en dessous de l'éminence médiane.
Figure 9-5 : Le complexe hypothalamo-hypophysaire - organisation et productions hormonales . L'adénohypophyse (lobe antérieur) est reliée à l'hypothalamus par le système porte-hypophysaire (circulation sanguine) alors que la neurohypophyse reçoit les terminaisons des cellules neurosecrétrices de différents noyaux hypothalamiques. Détails dans le texte.
b. hormones de l'adénohypophyse
L'adénohypophyse présente, dans ces différentes parties, différents types
cellulaires ayant fait l'objet de nombreuses classifications histologiques
souvent complexes et parfois contradictoires. Des techniques d'immunovisualisation
récentes permettent de classer ces cellules en différents types fonctionnels,
suivant le type d'hormones qu'elles produisent, toutes ces hormones étant de
nature protéique.
La pars distalis et la pars tubelaris contiennent essentiellement des cellules sécrétant des hormones à effet trophique, c'est à dire stimulant la production d'autres hormones.
On y trouvera ainsi :
- des cellules gonadotropes, sécrétant les gonadotropines LH (hormone
lutéinisante) et FSH (hormone folliculo-stimulante) qui vont activer les
productions d'hormones sexuelles au niveau des gonades ainsi que la formation
des gamètes (voir plus loin 2.2.6 et 2.3.6).
- des cellules thyréotropes dont la sécrétion, la TSH (hormone thyréotrope,
thyrotropine) active les productions hormonales de la thyroïde (voir plus loin 2.2.2).
- des cellules corticotropes produisant l'ACTH (hormone adénocorticotrope,
corticotropine) qui active la production de la partie corticale des glandes
surrénales (voir plus loin 2.2.5).
On y trouvera encore :
- des cellules dites lactotropes sécrétant la prolactine (PRL), une hormone
impliquée chez les mammifères dans le développement, la stimulation des
glandes mammaires et la montée laiteuse (voir 2.3.6).
La prolactine induit également le développement des glandes du jabot des
pigeons et la desquamation de leurs couches cellulaires internes formant le
"lait" de pigeon. Elle paraît également induire une tendance à la
couvaison chez les oiseaux ainsi qu'un comportement maternel chez les rongeurs.
Chez les poissons, elle pourrait par ailleurs jouer un rôle dans l'osmorégulation
puisqu'elle paraît impliquée dans le contrôle de la prolifération des
cellules à chlorure des branchies (cfr. chapitre 1).
- des cellules somatotropes sécrétant l'hormone de croissance (GH) qui joue un
rôle essentiel dans le développement pondéral de tous les organes et tissus.
La pars tubelaris est essentiellement riche en cellules gonadotropes produisant LH et FSH. Ces cellules représentent ainsi chez l'homme quelque 80 % des cellules de cette zone morphologique. Les autres types cellulaires cités ci-dessus y sont nettement plus rares et les productions de TSH, ACTH, PRL et GH proviennent essentiellement de la pars distalis qui produira également, comme nous l'avons vu, les gonadotropines LH et FSH.
La pars distalis produit encore deux facteurs polypeptidiques dont le rôle physiologique reste à définir mais qui pourraient avoir un effet sur la mobilisation des graisses, d'où leur nom de lipotropines (LPH). Ces facteurs proviennent en fait du clivage, dans les cellules corticotropes, d'une glycoprotéine, la pro-opio-mélanocortine (POMC), qui est le précurseur commun de l'ACTH et des LPH ainsi que des b endorphines et des hormones mélanotropes.
La production de b endorphines est plus importante au niveau de la pars intermedia qu'au niveau de la pars distalis. La pars intermedia produira encore à partir du POMC des hormones mélanotropes (a , b , g MSH) alors que la pars distalis produira surtout l'ACTH, chacun des lobes ayant ces propres modalités de clivage du précurseur.
Les b endorphines, agoniste des récepteurs aux opioïdes (cfr. chapitre 8) possèdent un important pouvoir analgésique. Les effets analgésiques centraux semblent cependant devoir être davantage attribués à la libération de b end. par des terminaisons nerveuses qu'à un relarguage hypophysaire. La b end. circulante ne passe en effet que très mal la barrière hémato-encéphalique et, par ailleurs, la b end. sécrétée par la pars intermedia est acétylée et tronquée dans sa portion C terminale par rapport à la b end. neuronale, ce qui la rend peu active sur les récepteurs aux opioïdes.
Les hormones mélanotropes agissent essentiellement sur les mélanocytes en stimulant la mélanogenèse (synthèse de mélanine) ainsi que la translocation des granules contenant la mélanine (mélanosomes). Une sécrétion de MSH provoquera donc chez l'homme un assombrissement de la peau. Chez les téléostéens, les mélanocytes sont sous contrôle d'une innervation adrénergique. Une stimulation des récepteurs provoque l'agrégation des mélanosomes et un éclaircissement alors qu'une stimulation b adrénergique assure leur dispersion et l'assombrissement.
c. hormones de la
neurohypophyse
La neurohypophyse produit deux hormones présentant de grandes analogies
structurales : l'hormone antidiurétique (ADH) et l'ocytocine (OT). Il s'agit en
effet dans les deux cas de peptides de 9 ou 10 acides aminés dont la structure
générale est restée extrêmement conservée chez les vertébrés. En ce qui
concerne l'ADH par exemple, seuls les acides aminés 3 et 8 ont en effet été
sujet à modifications au cours de l'évolution (figure 9-6).
Figure 9-6 : Structure des hormones neurohypophysaires (ADH et OT) chez les vertébrés.
Les deux hormones ont une origine hypothalamique, les fibres sécrétrices de la neurohypophyse émanant presque exclusivement de neurones de deux noyaux de l'hypothalamus : le noyau paraventriculaire et, surtout, le noyau supraoptique. La destruction sélective de ces noyaux entraîne la dégénérescence des fibres nerveuses de la tige hypophysaire et du lobe postérieur ainsi qu'un arrêt de la production hormonale.
L'hormone antidiurétique est synthétisée sous forme d'un précurseur macromoléculaire (± 20 KDa). Elle est impliquée essentiellement dans le contrôle de la réabsorption d'eau par le rein. Elle paraît également provoquer, à doses importantes, une certaine vasoconstriction, principalement des régions splanchniques et rénales. L'effet antidiurétique de l'hormone est présent, plus ou moins marqué, chez tous les tétrapodes. Chez les poissons, curieusement, seul un effet inverse, diurétique, a été décrit. Il est particulièrement spectaculaire chez les poissons pulmonés au niveau desquels la mesotocine, une hormone de la famille de l'ocytocine, est également active. Nous envisagerons les effets de l'ADH de façon plus détaillée en discutant le contrôle hormonal de la volémie sanguine (cfr. 2.3.2).
L'ocytocine induit des contractions de la musculature du tractus génital femelle essentiellement lors de la parturition mais aussi lors du coït. La sécrétion d'OT lors de l'accouchement est déclenchée par la descente du ftus et la dilatation du col de l'utérus. L'OT est également à la base du réflexe d'éjection du lait déclenché par la tétée, la traite ou la traction du mamelon. Chez différentes espèces non mammaliennes comme les amphibiens, l'ocytocine a des effets similaires à l'hormone antidiurétique, augmentant rapidement la perméabilité à l'eau de la peau et de la vessie. Elle stimule également le transport actif de sodium au niveau de ces épithélia.
d. contrôle des productions
du complexe neuro-adénohypophysaire
Les productions de l'adénohypophyse sont contrôlées par de nombreux facteurs
dont l'étude détaillée sort largement du cadre de cet ouvrage. Très
brièvement, il existe un contrôle nerveux important qui sera adrénergique,
GABAergique ou dopaminergique selon le cas. L'hypothalamus produit par ailleurs
des facteurs stimulant (libérines - RF : releasing factors) ou inhibant (statines
- IF : inhibiting factors) les productions hormonales. On trouvera ainsi des
prolactostatines (PRL - IF) et des prolactolibérines (PRL - RF) régulant la
sécrétion de prolactine, des gonadostatines (LH / FSH - IF) et des
gonadolibérines (LH / FSH - RF) régulant la sécrétion des hormones
gonadotropes, ou encore des thyréolibérines (TRF) stimulant la sécrétion des
thyrotropines, etc.
De nombreux autres facteurs peuvent encore intervenir.
Ainsi par exemple, le peptide intestinal vasoactif et d'autres peptides du même
groupe (VIP) exerce un puissant effet stimulant sur les cellules à prolactine,
notamment chez les primates et les rongeurs. Il en va de même pour l'ocytocine,
l'angiotensine II et la thyréolibérine. Les hormones thyroïdiennes (T3
notamment) exercent par contre un effet inhibiteur. Certains de ces effets
seront discutés dans le cadre de l'étude de quelques contrôles hormonaux (cfr.
2.3).
En ce qui concerne la neurohypophyse, le contrôle de la production d'ocytocine est relativement mal connu, la nature des réflexes d'éjection du lait ou de stimulation des contractions en cours de travail restant peu claires. La régulation de la sécrétion de l'ADH sera envisagée dans le cadre de l'étude du contrôle hormonal de la volémie (section 2.3.2).
2.2.2. La thyroïde
a. production et rôle des hormones
La thyroïde des mammifères contient deux types de cellules endocrines
produisant chacune des hormones différentes : les cellules folliculaires qui
forment les follicules thyroïdiens synthétisant et sécrétant les hormones
thyroïdiennes iodées. Les cellules parafolliculaires ou cellules C qui,
isolées ou regroupées en amas, sont localisées entre les follicules et
sécrètent essentiellement la calcitonine mais aussi deux peptides directement
apparentés, la katacalcine et le CGRP (calcitonine - gene - regulated -
peptide) et un peu de somatostatine.
La calcitonine intervient essentiellement dans la régulation du métabolisme calcique. Son rôle hypocalcémiant sera envisagé de façon plus détaillée dans le cadre de l'étude de quelques exemple d'effets hormonaux (cfr. 2.3.1 ci-après). Les cellules C thyroïdiennes n'existent que chez les mammifères. La calcitonine est produite par les corps ultimobranchiaux depuis les poissons jusqu'aux oiseaux. Chez les téléostéens, un facteur hypocalcique paraît également présent dans les corpuscules stannieux (cfr. 2.3.1).
Les hormones thyroïdiennes iodées interviennent essentiellement dans le contrôle du métabolisme oxydatif général. Elles favorisent ainsi la croissance générale et le développement. Elles sont par ailleurs indispensables à la métamorphose de différentes espèces (têtard de grenouille, plie). Elles paraissent également impliquées, à côté des glucocorticoïdes, dans la smoltification du saumon. A côté de ces effets sur le développement que l'on retrouve chez tous les vertébrés, les hormones thyroïdienne exercent des effets métaboliques en relation avec la thermogenèse spécifiquement chez les espèces homéothermes, oiseaux et mammifères (voir chapitre 12).
Aux doses physiologiques, ces hormones stimulent la production des enzymes respiratoires. Les mitochondries se développent et multiplient leurs crêtes. Il y a augmentation de la consommation d'oxygène et de la production d'ATP. En l'absence d'hormones, la consommation d'oxygène est réduite de moitié et le métabolisme oxydatif est bas. L'hypothyroïdisme peut ainsi conduire au nanisme, à l'infantilisme ou à l'idiotie (crétinisme). L'hyperthyroïdisme au contraire peut provoquer un gonflement des mitochondries avec augmentation importante de la consommation d'oxygène et du catabolisme cellulaire en même temps qu'un découplage des phosphorylations oxydatives. Il s'ensuit un arrêt de croissance et de dynamisme pouvant conduire à la cachexie.
b. synthèse des hormones
thyroïdiennes
Les hormones thyroïdiennes sont formées à partir d'une grosse protéine, la
thyroglobuline, qui fixe l'essentiel de l'iode se trouvant dans l'organisme
(chez l'homme : 8 des 9 mg d'iode total). La thyroglobuline est une
glycoprotéine synthétisée dans les cellules folliculaires de manière
relativement complexe impliquant l'addition de parties glucidiques dans le
reticulum et le Golgi (cfr. figure 9-7D). Une fois formée,
elle est exocytée au pôle apical des cellules dans le colloïde central du
follicule où elle est iodée à partir d'iode actif résultant de l'oxydation
par une peroxydase, dans les cellules folliculaires, d'iodure pompé dans le
sang. La thyroglobuline iodée est alors endocytée par les cellules
folliculaires et clivée dans les lysosomes en donnant naissance aux
différentes hormones thyroïdiennes (iodothyrosines et iodothyronines) parmi
lesquels la T4 (Thyroxine) est la plus importante (figure
9-7B). Les hormones ainsi formées peuvent alors être déversées dans le
sang.
Figure 9-7ABC : Les hormones thyroïdiennes. A : Vue en microscopie électronique d'une section de glande montrant les structures folliculaires avec leur lumière de substance colloïdale (SC) et les cellules les entourant. B : Structure des hormones thyroïdiennes. C : Vue en microscopie électronique d'une cellule folliculaire. La thyro-globuline est endocytée à la face apicale et transformée dans les lysosomes (L) en hormones thyroïdiennes qui sont relarguées dans le sang (EV : endothélium vasculaire, GR : globules rouges).
Figure 9-7D : Les hormones thyroïdiennes. Schéma explicatif des mécanismes de synthèse. Détails dans le texte.
c. contrôle de production des
iodothyronines
La thyroïde reçoit une importante innervation adrénergique, cholinergique et
peptidergique qui paraît pouvoir moduler l'effet de l'hormone thyréotrope. La
nature exacte de cette modulation ainsi que son rôle physiologique sont
cependant loin d'être élucidés. Le taux de T3 et T4
circulantes exerce par ailleurs un contrôle en rétroaction sur la production
de TSH. Les variations de température saisonnières paraissent également
influencer sa production, ce qui aboutit à une augmentation du métabolisme de
base en période froide et à une diminution en période chaude (figure
9-8).
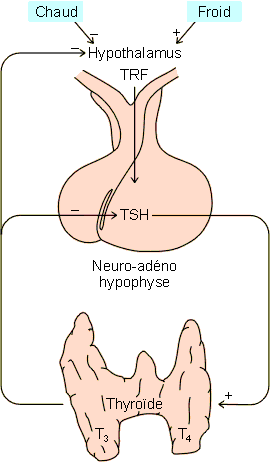 |
Figure 9-8 : Contrôle de la production des hormones thyroïdiennes. TRF : thyrolibérine, TSH : hormone thyréotrope. |
2.2.3. Les parathyroïdes
Habituellement au nombre de 3 ou 4 chez l'homme, ces petites glandes, ne
mesurant que quelques millimètres, sont incrustées sur la face postérieure de
la thyroïde. Elles produisent la parathormone (PTH) qui, avec la calcitonine,
joue un rôle important dans l'équilibre calcique et la fixation du calcium au
niveau des os (cfr. 2.3.1). La PTH joue également un
rôle important dans la régulation de la teneur en phosphate du sang en
stimulant le transport de PO4 au niveau rénal.
Le stimulus majeur contrôlant la sécrétion de PTH paraît être le calcium. Chez le veau nouveau-né par exemple, la quantité de PTH sécrétée est directement liée à la quantité de calcium présente dans le sang, l'hypocalcémie augmentant la sécrétion et l'hypercalcémie la diminuant.
Les parathyroïdes sont présentes à partir des amphibiens et paraissent absentes chez les poissons. Il existe des facteurs de type PTH chez les poissons osseux ; ils seraient élaborés au niveau de la pars distalis de l'adénohypophyse (cfr. 2.3.1).
2.2.4. Ilots endocrines du
pancréas
Le pancréas est une glande à la fois endocrine et exocrine. En temps que
glande exocrine, il participe de façon essentielle à la digestion par sa
production de différentes enzymes digestives (cfr. chapitre 5, sections 2 et 4.3.1). Le pancréas
contient par ailleurs de minuscules amas de cellules endocrines (îlots de
Langerhans). On y trouve essentiellement des cellules de deux types, a et b , produisant
respectivement le glucagon et l'insuline. On trouve également des cellules d qui sécrètent de la somatostatine dont le rôle est
d'inhiber toute sécrétion d'insuline ou de glucagon. D'autres cellules encore
produisent un polypeptide pancréatique (PP) dont le rôle physiologique exact
reste toujours inconnu. Il semble qu'il pourrait agir sur les processus
digestifs en stimulant notamment la sécrétion et la motricité gastrique.
L'insuline et le glucagon ont des effets marqués sur le métabolisme glucidique. Ces hormones vont dès lors jouer un rôle essentiel dans la régulation du taux de glucose sanguin (glycémie), l'insuline étant hypoglycémiante et le glucagon hyperglycémiant. Ces effets seront envisagés de façon plus détaillée dans la section 2.3 (cfr. 2.3.3).
2.2.5. Les surrénales
Les glandes surrénales se présentent chez l'homme comme de petites structures
pyramidales localisées au sommet des reins. Elles sont formées par
l'association de deux portions endocrines distinctes tant par leurs origines
embryologiques que leurs fonctions. Le cortex surrénalien, dérivé du
mésoderme, produit des stéroïdes (minéralo et glucocorticoïdes - figure 9-9) alors que la partie médullaire (tissu chromaffine),
dérivée du neuroectoderme et plus particulièrement des crêtes neurales,
élabore des catécholamines. Tissus stéroïdien et chromaffine se présentent
sous forme d'amas cellulaires séparés chez les poissons cartilagineux ;
ils se rapprochent de plus en plus au cours de l'évolution pour s'unir en une
seule glande chez les mammifères.
Les catécholamines produites par la zone médullaire, essentiellement adrénaline et noradrénaline mais aussi dopamine, vont avoir un rôle important dans les réactions aux stress (cfr. section 2.3.4).
Les différents stéroïdes sont produits dans des zones distinctes de la région corticale. La plus extérieure (zone glomérulée) produit des minéralocorticoïdes dont l'aldostérone (figure 9-9) est certainement le plus puissant et le plus important (95 % de la production totale chez l'homme). L'aldostérone agit sur la réabsorption rénale de sodium et joue ainsi un rôle important dans le contrôle de la natriémie sanguine et de la balance hydrominérale de l'organisme (cfr. section 2.3.2). Les zones internes (fasciculée et réticulée) produisent essentiellement des glucocorticoïdes (cortisol, cortisone et corticostérone - figure 9-9 - seul le cortisol est sécrété en quantités notables chez l'homme). Ces hormones exercent des effets métaboliques notables. Elles interviendront notamment dans la production de glucose et d'acides gras lors du stress ainsi que dans la régulation à long terme de l'activité du métabolisme glucidique, lipidique et protéique, favorisant ainsi le fonctionnement normal de l'organisme (cfr. sections 2.3.4 et 5). Ces effets métaboliques ne sont marqués que chez les oiseaux et surtout les mammifères. Chez les espèces non mammaliennes, cortisol et corticostérone ont avant tout des effets sur la balance hydrominérale par activation de la Na+/K+ ATPase au niveau des tissus transporteurs d'ions (branchies, reins, glandes à sel). Ils peuvent agir dans ce cadre indépendamment de ou en synergie avec l'aldostérone.
La zone réticulée élabore également de petites quantités d'hormones sexuelles : les gonadocorticoïdes. On trouve parmi celles-ci des androgènes et des strogènes. Normalement la production d'androgènes prédomine. Leurs effets virilisants sont en général peu visible chez l'homme adulte où la testostérone testiculaire prédomine largement. Ces effets sont toutefois non négligeables chez le jeune homme, avant la puberté. Ils pourraient par ailleurs être déterminants dans le développement de la libido et d'une certaine masculinisation chez la femme (augmentation de pilosité et hypertrophie clitoridienne).
Chez le ftus et le nouveau-né des primates, on trouve une zone particulière très développée qui produit un androgène particulier en grandes quantités : la deshydroépiandrostérone (DHEA). Cette zone, dite ftale, cesse progressivement de fonctionner après la naissance et dégénère rapidement. Chez l'homme, une petite production de DHEA est maintenue au niveau de la zone réticulée jusqu'à l'âge de 20 ans. Le rôle physiologique de cette hormone reste obscur. Chez le ftus, elle pourrait servir de précurseur pour la synthèse d'strogènes par le placenta (cfr. figure 9-9).
Figure 9-9 : Les hormones stéroïdes. Produites par les gonades et les surrénales, elles ont pour précurseur commun le cholestérol. Le groupe des hormones sexuelles (bleu) comprend des hormones femelles (progestérone, strone, stradiol) et mâles (testostérone et dihydrotesto-stérone). Elles sont toutes formées dans les gonades à l'exception de l'hormone mâle deshydroépi-androstérone (DHEA) qui est synthétisée par les surrénales. Les autres hormones surrénaliennes (beige) comprennent des minéralocorticoïdes (aldostérone) et des glucocorticoïdes (cortisol, cortisone, corticostérone). Détails dans le texte.
2.2.6. Les gonades
Les hormones dites sexuelles produites par les gonades sont toutes de nature
stéroïde. Elles sont élaborées par les ovaires chez la femelle et les
testicules chez le mâle.
Les ovaires synthétisent deux grands types d'hormones "femelles" : les strogènes et la progestérone. Les premières provoquent la maturation des organes génitaux et l'apparition des caractères sexuels secondaires femelles (cfr. 2.3.6). La progestérone est plus particulièrement impliquée dans la préparation du système reproducteur à la réception d'un uf fécondé et à sa gestation (cfr. 2.3.6). Elle a également des effets sur la production des glandes mammaires.
Les testicules sécrètent en particulier la testostérone, hormone "mâle" qui suscite la maturation des organes génitaux masculins, l'apparition des caractères sexuels secondaires et l'émergence de la libido. Elle est par ailleurs nécessaire à la production de spermatozoïdes ainsi qu'au bon fonctionnement des organes génitaux chez le mâle adulte (cfr. 2.3.6).
2.2.7. Autres glandes
A côté de ces glandes importantes, il convient d'en citer rapidement quelques
autres tels la glande pinéale, le thymus, le tube digestif ou le cur.
a. la glande pinéale et le
complexe épiphysaire
La glande pinéale est, chez les mammifères et les oiseaux, une petite
structure accrochée au toit du troisième ventricule, dans le diencéphale.
Chez les poissons, les amphibiens et différents reptiles (lézards notamment),
cette structure est associée à deux autres projections du troisième
ventricule, l'organe pariétal ou parapinéal et la paraphyse. La pinéale se
retrouve chez tous les vertébrés à l'exception des crocodiliens, les deux
autres formations ne sont guère bien développées que chez quelques
groupes : l'organe parapinéal chez les cyclostomes et les lézards, la
paraphyse chez les amphibiens. La pinéale contient des cellules sécrétrices
dont la seule production notable paraît être la mélatonine qui exerce chez de
nombreuses espèces des effets sur le comportement sexuel et les gonades,
l'alimentation, le sommeil, la sécrétion des gonadotropines de l'adénohypophyse
et peut être aussi sur la production d'autres hormones trophiques.
Le rôle physiologique de la pinéale reste obscur. Elle reçoit des voies visuelles des influx relatifs à l'intensité et à la durée de l'éclairement. Elle pourrait dès lors être impliquée, via la mélatonine, dans les voies responsables de différents processus physiologiques rythmiques, en relation avec les cycles chronobiologiques.
b. le thymus
Le thymus est une glande souvent volumineuse chez le jeune et qui s'atrophie
avec l'âge. Chez tous les vertébrés, sauf les mammifères, il s'agit d'un
organe pair situé en arrière de la tête, dorsalement chez les poissons et les
amphibiens, ventralement et dans le cou chez les reptiles et les oiseaux. Chez
les mammifères, il se présente comme un organe impair, formé de deux lobes
contigus coiffant le sommet du cur, dans la cage thoracique.
Le thymus joue un rôle important comme organe lymphoïde (lieu de maturation et de différentiation des cellules leucocytaires). Il joue également un rôle fondamental dans le fonctionnement du système immunitaire par la production d'hormones tels que thymosine, thymaline, thymopoïétine ou facteur thymique humoral (THF). Ces substances interviennent en effet plus particulièrement dans le contrôle de la maturation des lymphocytes T et de l'activité de différentes phases de la réponse immunitaire (cf. chapitre 10).
Les productions hormonales thymiques mettent bien en évidence les interrelations existant entre le système immunitaire et le système endocrinien. Lymphocytes, macrophages et leucocytes montrent par ailleurs des productions immunoréactives d'ACTH, d'endorphines, de TSH ou de GH. Ces hormones sont identiques à ou sont très proches de celles produites par les glandes endocrines et peuvent activer les mêmes récepteurs. Les relations immuno - endocriniennes seront envisagées plus en détail au chapitre 10 concernant les mécanismes de défense des organismes.
c. le tube digestif
Comme nous l'avons déjà signalé, le tube digestif est le siège, en divers
endroits, d'une production hormonale importante, essentiellement liée à la
régulation de la fonction digestive. Le rôle de ces hormones a été abordé
au chapitre 5 dans le cadre de l'étude de cette
fonction ; nous n'y reviendrons donc pas ici.
d. le cur et le facteur
atrial natriurétique
La démonstration de la sécrétion d'un facteur hormonal par le cur et plus
particulièrement par le tissu auriculaire est relativement récente puisqu'elle
date des années 1970. On a en effet pu montré à l'époque qu'un extrait de
tissu auriculaire injecté dans la circulation exerçait un puissant effet
diurétique et natriurétique au niveau rénal et manifestait un pouvoir
relaxant, hypotenseur, au niveau de la circulation générale. Le facteur
hormonal en cause, produit par certains myocytes du tissu auriculaire, fut
isolé pour la première fois en 1985 et fut appelé facteur atrial
natriurétique (ANF). Il a maintenant été mis en évidence chez tous les
vertébrés, des poissons aux mammifères. Il s'agit d'un peptide de 27 ou 28
acides aminés de structure assez bien conservée (27 chez l'anguille, 28 chez
le rat et l'homme ; la différence entre le peptide de l'homme et du rat ne
porte que sur l'acide aminé en position 12).
Le facteur déclenchant la production de l'ANF paraît être la distension des oreillettes. L'hormone produite va induire une vasodilatation, une augmentation de la diurèse, une réduction de sécrétion d'aldostérone et une suppression de la sécrétion de rénine (cfr. section 2.3.2).
2.3.1. Régulation hormonale de
la calcémie sanguine
Le calcium est un élément majeur de la structuration des os et des dents. Il
intervient par ailleurs dans toute une série de processus tels que contraction
musculaire, exocytose ou signalisation intracellulaire. Sa concentration
sanguine (± 2,5 mM chez les mammifères) doit donc
être régulée avec précision. Lhoméostasie du calcium sanguin résulte
essentiellement des mouvements de l'ion au niveau osseux, urinaire et intestinal
(figure 9-10). Trois substances vont intervenir dans le
contrôle de ces mouvements : la parathormone, la calcitonine et la vitamine D3.
Figure 9-10 : Les éléments de l'homéostasie du calcium sanguin chez l'homme. CT : calcitonine PTH : parathormone Vit D3, 25 OH D3 et 1-25 (OH)2 D3 : vitamine D3 ou cholécalciférol et dérivés hydroxylés. Détails dans le texte.
La vitamine D3 ou cholécalciférol peut être obtenue par apport alimentaire ou synthétisée par irradiation UV du 7-deshydrocholestérol. Les amphibiens, les reptiles, les oiseaux et les mammifères possèdent ainsi des zones réceptrices aux UV au niveau desquels s'effectue la synthèse (peau chez l'homme, pattes chez les oiseaux, oreilles chez les lapins). Les poissons paraissent capables d'élaborer la vitamine sans l'aide des UV. Une fois formée ou assimilée, la Vit D3 est transportée par une protéine sérique au niveau du foie où elle peut être hydroxylée en 25-hydroxycholécalciférol. Elle sera alors transportée du foie au rein pour y subir une nouvelle hydroxylation soit en C-1 pour former un produit actif, le 1-25 dihydroxycholécalciférol (1-25 (OH)2 D3), soit en C-24 pour former un produit inactif. Les effets combinés de différents modulateurs sur les enzymes impliquées, la 1-hydroxylase et la 24-hydroxylase, vont permettre de contrôler la concentration du métabolite actif. Ainsi par exemple, une calcémie basse augmente la production de 1-25 (OH)2 D3. Cet effet implique une activation de la 1-hydroxylase et une inhibition de la 24-hydroxylase ; une calcémie élevée a l'effet inverse. Ces effets paraissent dus aux modifications de production de parathormone qu'entraînent les variations de la calcémie ; la parathormone stimule en effet directement la synthèse de la 1-hydroxylase. Une phosphatémie basse augmente également la production de 1-25 (OH)2 D3. Contrairement à ce que l'on observe pour l'hypocalcémie, cet effet ne parait pas faire intervenir la PTH.
Le 1-25 (OH)2 D3 peut par ailleurs exercer une inhibition en rétroaction de sa propre synthèse par répression de la 1-hydroxylase et induction de la 24-hydroxylase. Il est d'autre part intéressant de remarquer que les hormones femelles (strogènes), via l'augmentation de prolactine qu'elles entraînent, augmentent l'activité 1-hydroxylasique. Ce processus est particulièrement marqué chez les oiseaux où il intervient au moment de la ponte, dans la calcification de la coquille de luf.
Le métabolite actif de la vitamine D3 joue un rôle essentiel dans le contrôle de l'absorption intestinale de calcium qu'il active largement. Le mécanisme impliqué dans cette activation reste à l'heure actuelle obscur. Le 1-25 (OH)2 D3 paraît stimuler à la fois l'influx calcique au pôle apical des entérocytes et l'efflux au pôle basal. Il induit également la formation dans les cellules intestinales d'une protéine fixant le calcium, la calbindine D, qui pourrait intervenir dans le transport intracellulaire de l'ion du pôle muqueux au pôle séreux.
La parathormone, produite par les glandes parathyroïdes (cfr. 2.2.3 ci-avant), entraîne une mobilisation du calcium osseux 1) par activation de la résorption osseuse par les ostéoclastes ; 2) par augmentation de la réabsorption de l'ion au niveau rénal. La PTH apparaît donc dans ce cadre comme une hormone hypercalcémiante.
La calcitonine, produite par les cellules parafolliculaires (cellules C) de la thyroïde, a par contre un effet hypocalcémiant. L'hormone agit essentiellement en inhibant l'activité de résorption osseuse des ostéoclastes. Alors que le mécanisme d'activation des ostéoclastes par la PTH paraît indirect et reste peu clair, le mécanisme d'inhibition de la résorption par la CT est relativement bien connu. L'hormone agit en inhibant la formation et la libération des enzymes lysosomiaux des ostéoclastes qui normalement lysent la trame osseuse. La CT inhibe par ailleurs légèrement la réabsorption de calcium au niveau rénal chez certaines espèces, ce qui contribue à son effet hypocalcémiant. L'importance physiologique des effets rénaux de la CT chez l'homme reste très discutée à l'heure actuelle.
Les glandes parathyroïdes paraissent absentes chez les poissons qui, de plus, sont assez insensibles à la parathormone ou à des extraits de parathyroïdes de tétrapodes. Chez les téléostéens, des facteurs hypercalcémiants semblent présents dans l'adénohypophyse. Un de ceux-ci pourrait être la prolactine. Un facteur hypocalcémiant de type calcitonine paraît présent dans les corps ultimobranchiaux. Un autre agent hypocalcique (hypocalcine ou stanniocalcine) a par ailleurs été mis en évidence dans les corpuscules stannieux. Chez les tétrapodes jusqu'aux oiseaux, les glandes parathyroïdes sont présentes et produisent une hormone hypercalcémiante de type parathormone. Elles restent plus ou moins associées aux corps ultimobranchiaux qui eux produisent une hormone hypocalcémiante de type calcitonine.
2.3.2. Régulation hormonale de
la volémie et de la natriémie
Le maintien d'un volume liquidien et d'une osmolarité constants est d'une
importance capitale pour le bon déroulement des activités cellulaires (cfr. chapitre 1). De nombreuses structures dévolues
partiellement ou exclusivement à ce rôle sont dès lors apparues au cours de
l'évolution (branchies, glandes à sel, rein, intestin : cfr. chapitre 1). Différents facteurs hormonaux
participent au contrôle de l'activité de ces structures et vont donc concourir
au maintien du volume, de la teneur en NaCl et de l'osmolarité sanguine. Les
principaux facteurs impliqués sont l'hormone antidiurétique, l'aldostérone
(chez les mammifères, souvent avec la corticostérone ou le cortisol chez les
autres tétrapodes, cfr. 2.2.5), le facteur natriurétique
auriculaire et le système rénine - angiotensine.
a. l'hormone antidiurétique
1) Effets biologiques
Nonapeptide sécrété au niveau de la neurohypophyse (figure
9-6, 2.2.1.c), l'ADH a essentiellement pour effet
d'augmenter la perméabilité à l'eau de la paroi du tube collecteur du rein (figure 9-11A). Il en résulte une augmentation de la
réabsorption d'eau et dès lors une diminution de la diurèse. Il semble que
l'hormone agisse en favorisant l'ouverture d'aquaporines (canaux à eau ou
hydrophores) à la face apicale des cellules. A doses élevées, l'ADH exerce de
plus un léger effet vasopresseur par augmentation du tonus des muscles lisses
des vaisseaux. Ce fut en fait son premier rôle découvert d'où le nom de
vasopressine donné à l'hormone des mammifères (figure 9-6,
section 2.2.1.c). La vasopressine mammalienne paraît
par ailleurs capable de stimuler la production d'aldostérone du cortex des
surrénales, ce qui contribue à faciliter la résorption rénale de NaCl et
dès lors celle de l'eau (voir b, ci-après).
 |
Figure 9-11A : Hormone antidiurétique chez les mammifères. Effet sur la conductivité hydraulique de la paroi du tubule collecteur de rein de lapin. |
2) Contrôle de production
Les facteurs contrôlant la sécrétion d'ADH ont été étudiés
essentiellement chez les mammifères. Chez le rat comme chez l'homme, la
sécrétion est affectée par des modifications d'osmolarité ou de volume
sanguin (figure 9-11B). Ce dernier paramètre est
vraisemblablement perçu par les mécanorécepteurs carotidiens et aortiques
enregistrant la pression artérielle (cfr. chapitre
2). Les variations d'osmolarité seraient perçues essentiellement au niveau
d'osmorécepteurs hypothalamiques. Pour une osmolarité inférieure à 280 mOsm/kg,
la concentration en ADH circulante est si faible qu'elle ne peut être mesurée
de façon fiable ; au-delà de ce seuil, la production d'hormone augmente très
rapidement et proportionnellement à l'osmolarité plasmatique. Ainsi, une
augmentation de 1 % seulement de l'osmolarité sanguine suffit pour entraîner
un accroissement de concentration en ADH de 1 pg/ml, quantité suffisante pour
modifier significativement le débit urinaire. Quand l'osmolarité plasmatique
atteint 295 mOsm/kg, la vasopressinémie est suffisante (±
5 pg/ml) pour provoquer une antidiurésie maximale (figure
9-11B). Les osmorécepteurs paraissent sensibles à la variation d'osmolarité
per se plutôt qu'à l'augmentation de concentration de l'un ou l'autre
soluté sanguin. Une augmentation d'osmolarité réalisée par injection de
mannitol ou de saccharose est en effet tout aussi efficace que le NaCl
hypertonique pour activer la sécrétion d'hormone.
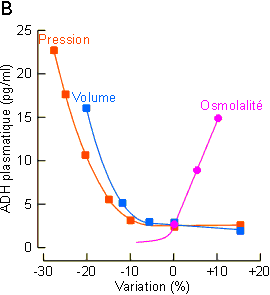 |
Figure 9-11B : Hormone antidiurétique chez les mammifères. Comparaison des effets des changements d'osmolarité, de pression et de volume sanguin sur la teneur plasmatique en ADH. |
En cas de déshydratation, les différents facteurs de contrôle (osmolarité, volume, pression) sont clairement liés : une baisse de volume et donc de pression artérielle correspond en effet à une augmentation d'osmolarité. Ils peuvent cependant agir indépendamment. Ainsi, l'hypovolémie résultant d'une hémorragie peut induire une libération de vasopressine même si le plasma est maintenu hypoosmotique. De même l'injection d'une solution hyperosmotique de NaCl ou de mannitol induit une libération d'hormone alors qu'il n'y a pas de diminution du volume sanguin.
Curieusement, le froid et l'alcool ont des effets inhibiteurs sur la production de vasopressine, ce qui peut rendre compte de leurs effets diurétiques. A l'inverse et tout aussi curieusement, la sollicitation du centre du vomissement de même que la traction des intestins induit une production de vasopressine. Ce dernier effet peut rendre compte de l'importante rétention d'eau qui est couramment observée lors d'une intervention chirurgicale au niveau du tractus gastro-intestinal.
b. l'aldostérone
1) Effets biologiques
Stéroïde produit par le cortex de la surrénale, l'aldostérone (figure 9-9) induit essentiellement une augmentation de la
réabsorption de Na+ au niveau rénal. Cet effet parait lié à une
augmentation de l'activité Na+/K+ ATPasique. On
considère par ailleurs que l'hormone peut intervenir directement dans le
contrôle de la kaliémie en stimulant la sécrétion rénale du K+
lorsque sa concentration sanguine est trop élevée.
L'effet de l'aldostérone sur la Na+/K+ ATPase paraît assez général. Il existe chez les tétrapodes non seulement au niveau du rein mais aussi de l'intestin, notamment dans sa portion colonique. On le trouve également au niveau de la peau et de la vessie chez les amphibiens, du cloaque chez les oiseaux, etc. Il est donc essentiellement marqué au niveau des épithélia transportant du sodium. Rappelons que chez les espèces non mammaliennes, les glucocorticoïdes, et en particulier le cortisol ont des effets similaires ; leur rôle majeur étant d'intervenir au côté ou à la place de l'aldostérone dans le contrôle des mouvements de sodium (cfr. 2.2.5).
2) Contrôle de production
Différents facteurs interviennent dans le contrôle de la production
d'aldostérone.
La diminution de concentration en NaCl de même que l'augmentation en KCl du sang induit une augmentation de sécrétion par activation de l'axe fonctionnel hypothalamus - hypophyse surrénales (via l'ACTH). L'ACTH paraît cependant agir de façon nettement plus importante sur la production des glucocorticoïdes que sur celle des minéralocorticoïdes. Les stimuli nerveux intervenant dans le contrôle des productions du cortex surrénalien restent à l'heure actuelle peu clairs. Deux autres facteurs interviennent de façon importante dans le contrôle de la production d'aldostérone : l'angiotensine produite par le système rénine - angiotensine (SRA) et le facteur natriurétique auriculaire (ANF).
c. le système rénine -
angiotensine
Ce système apparaît comme le plus important intervenant dans le contrôle de
la production d'aldostérone. Il intervient également de façon majeure dans le
contrôle de la volémie. Il participe d'un axe hormonal impliquant le rein et
le foie.
Le fonctionnement du SRA implique tout d'abord une sécrétion de rénine par un appareil juxtaglomérulaire situé à l'entrée du glomérule chez les mammifères. Cet appareil est constitué de deux parties distinctes (figure 9-12A). La première se situe sur le vaisseau afférent et contient des cellules dites juxtaglomérulaires qui sont les seules à pouvoir sécréter la rénine. Elles paraissent essentiellement sensibles à la volémie et dès lors à la pression artérielle qui serait enregistrée par des barorécepteurs se trouvant directement dans l'organe. La seconde, la Macula densa, se situe sur la partie distale du néphron jouxtant le vaisseau afférent. Les cellules de la Macula densa sont sensibles à la concentration en sodium du tubule rénal et peuvent induire, en fonction de ce paramètre, une production de rénine des cellules juxtaglomérulaires. Les deux stimuli efficaces, diminution de pression artérielle (volume) et diminution de teneur en Na du tubule, peuvent agir simultanément ou indépendamment l'un de l'autre.
Chez les autres vertébrés, une Macula densa structurée ne se trouve que chez les oiseaux. On retrouve par ailleurs au niveau du rein des cellules capables de sécréter la rénine chez toutes les espèces jusqu'aux poissons téléostéens, y compris ceux ayant des reins aglomérulaires. Les cyclostomes ne paraissent pas posséder de SRA fonctionnel. La situation est moins claire chez les poissons cartilagineux où des études récentes indiquent chez certaines espèces la présence de structures similaires à la Macula densa et aux cellules juxtaglomérulaires. Bien que des études physiologiques restent nécessaires, il semble que les sélaciens au moins puissent posséder un système comparable au SRA des mammifères.
Le SRA implique par ailleurs la production par le foie d'une glycoprotéine, l'angiotensinogène, qui est déversée dans le sang. La synthèse de cette protéine peut être stimulée notamment par différents stéroïdes tels les strogènes et les glucocorticoïdes.
La rénine déversée dans le sang par les cellules juxtaglomérulaire va produire par hydrolyse de l'angiotensinogène, un décapeptide, l'angiotensine I qui sera lui-même converti par une enzyme dite de conversion en un octapeptide, l'angiotensine II (ou hypertensine) ou un heptapeptide, l'angiotensine III.
Figure 9-12A : Le système rénine - angiotensine. Localisation de l'appareil juxtaglomérulaire, de la Macula densa et formation des angiotensines. CJG : cellules juxtaglomérulaires, EC : enzyme de conversion , MD : Macula densa.
Les trois peptides formés (angiotensine I, II et III) ont différents effets biologiques dont les plus importants sont ceux de l'angiotensine II (figure 9-12BC).
L'angiotensine I peut apparemment faciliter la production de catécholamines de la médullosurrénale. Elle aurait ainsi essentiellement des effets vasoconstricteurs qui paraissent cependant rester de peu d'importance physiologique. L'angiotensine II a par contre des effets vasoconstricteurs marqués. Elle induit par ailleurs la production d'aldostérone de la zone glomérulée du cortex surrénalien. Elle a également de notables effets centraux. Dans ce cadre, elle induit très rapidement une forte sensation de soif. Elle pourrait par ailleurs stimuler les productions d'ACTH et d'ADH hypophysaires ; ces derniers effets ne sont cependant pas encore très clairement établis. L'angiotensine III paraît aussi efficace que l'angiotensine II à stimuler la sécrétion d'aldostérone. Son effet vasoconstricteur et ses effets centraux paraissent par contre nettement moindre, voire physiologiquement non significatifs. Les activités relatives des angiotensines II et III sont variables d'espèce à espèce. Chez l'homme, l'angiotensine III n'interviendrait que pour quelque 10 % dans l'activité angiotensine totale alors que chez le rat elle serait responsable de près de 60 % de cette activité.
Chez les poissons, où l'aldostérone n'intervient pas dans la balance hydrominérale, l'angiotensine II provoque la sécrétion de cortisol. Chez les amphibiens, les reptiles et les oiseaux où cortisol et aldostérone paraissent pouvoir intervenir ensemble, l'angiotensine induit la sécrétion des deux hormones.
Figure 9-12BC : Le système rénine - angiotensine. Effets des angiotensines (B) et structure des angiotensines II chez les vertébrés (C). AI - AII - AIII : angiotensines 1, 2 et 3.
d. le facteur natriurétique
auriculaire
Un autre facteur pouvant intervenir dans le contrôle de la production
d'aldostérone est le facteur natriurétique auriculaire ou atrial
natriurétique (ANF, cfr. 2.2.7). L'ANF parait en effet
inhiber directement la libération d'aldostérone. Il inhibe également la
sécrétion de rénine, ce qui pourrait rendre compte d'un effet indirect sur la
production d'aldostérone mais aussi de la diminution de la résistance
vasculaire périphérique et donc de la diminution de la pression artérielle
qu'il provoque. L'ANF induit par contre spécifiquement une vasoconstriction des
artérioles efférentes du glomérule sans provoquer de modification
concomitante du débit d'arrivée. Il s'ensuit une augmentation de
l'ultrafiltration qui peut être importante. Chez l'homme, le débit urinaire
peut ainsi être multiplié par 20 et l'excrétion de sodium par 30. Ces effets
atteignent un maximum après 5 à 10 minutes et ne durent en général pas plus
de 20-25 minutes. L'ANF paraît par ailleurs avoir des effets centraux,
antagonistes de ceux de l'angiotensine II, inhibant notamment la sensation de
soif.
e. autres hormones
On sait maintenant depuis près de 40 ans que la prolactine, hormone
étroitement associée aux fonctions de reproduction chez les mammifères, a des
effets marqués sur l'osmorégulation chez les téléostéens. Chez les poissons
d'eau douce, la PRL intervient dans le contrôle de la perméabilité à l'eau
et aux ions des téguments extérieurs. Elle semble par ailleurs stimuler le
pompage actif branchial et rénal de NaCl.
La PRL a également des effets osmotiques marqués entraînant chez différents batraciens et en particulier les tritons, un mouvement du milieu terrestre vers le milieu aquatique où ils s'accouplent et se reproduisent ("water - drive - effect"). Cet effet est si net qu'il a constitué pendant longtemps un test biologique de mise en évidence de la prolactine. Son mécanisme interne reste peu clair à l'heure actuelle.